よむ、つかう、まなぶ。
【資料2】柏谷構成員提出資料 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35743.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第4回 10/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
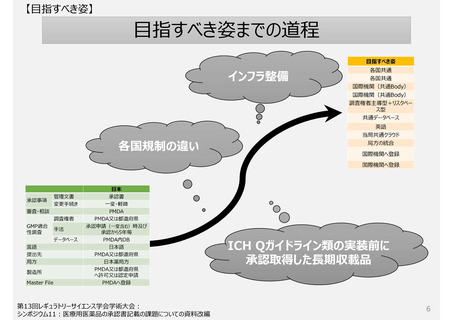
【日本の現状:課題】
1.
日本の独自制度から生じる問題-詳細-
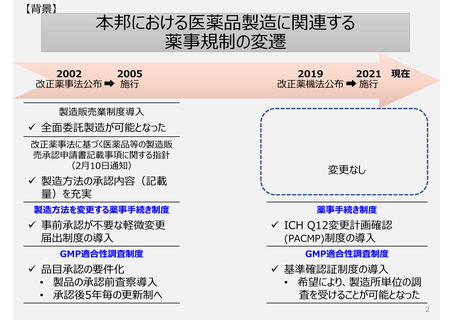
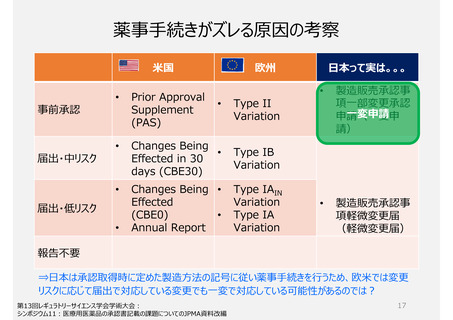
製造方法(規格及び試験方法等を含む)を変更する手続き制度
変更届出制度は、届出直後に変更の妥当性確認が行われないため、手続き間違いによる品質事案の発生を防ぐこと
が出来ない。また、変更届時と数年後に行われる変更の妥当性確認時で科学の進歩や見解の変化により、届出が不
適切と判断されてしまう場合がある。
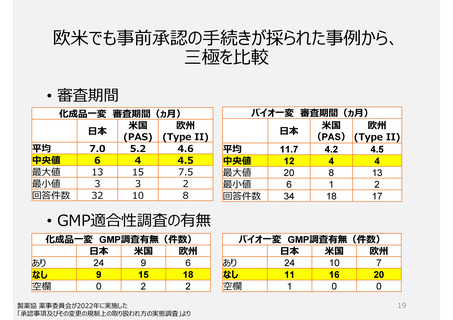
参考)欧米は、高中低リスクの区分
日本の変更届出制度と同等制度とされている欧米の中低リスク変更のための届出手続きには、その手続きを行った際に手続きカテゴリと変
更内容の妥当性を当局が短時間で判断・審査が完了する仕組みがある。
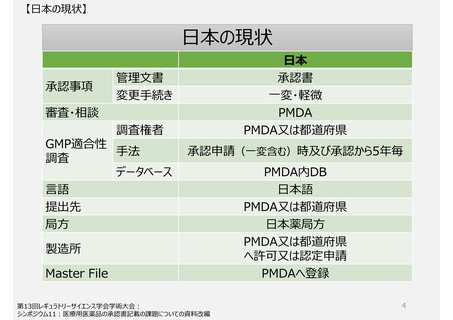
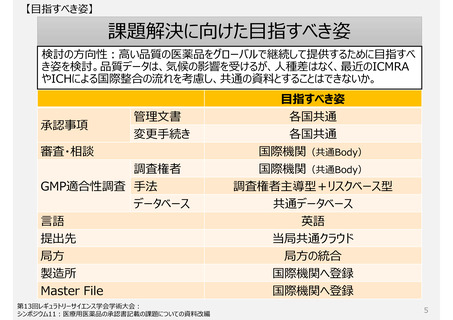
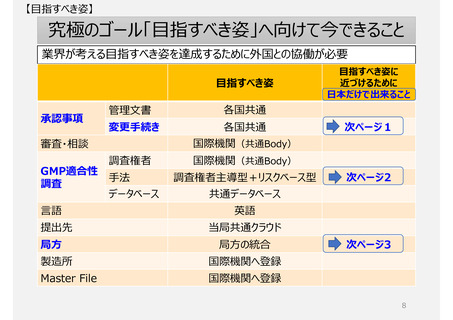
承認事項(特に製造方法)
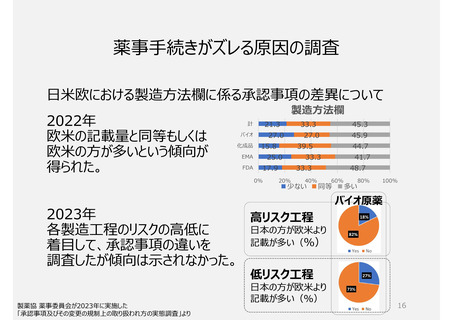
助詞を含め一言一句が承認事項となっている。ヒューマンエラーによる「誤記」も承認書の齟齬と扱われ、修正するため
にも薬事手続きを経る必要がある。(日本と欧米の製造方法の記載量・内容に特徴的な差はない)
承認申請時のリスク評価に基づき設定された、将来変更時の手続き区分を示す独特の記号を付すため、変更時点の
リスク評価により変更レベルが判断される欧米の変更手続きと異なる場合がある。
同じ変更でも日本の方が時間と手間がかかる対応が発生することがあり、出荷時期の予見性が低くなり、安定供給に
影響がでる
2.
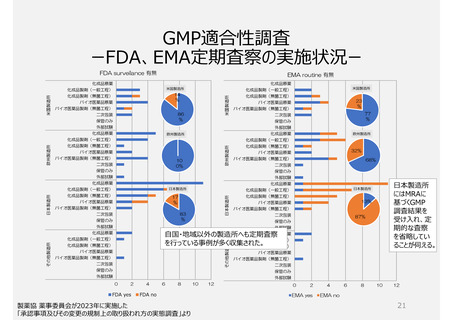
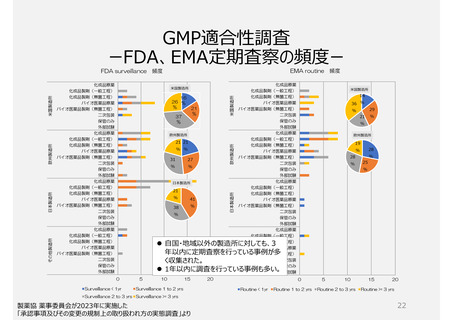
GMP適合性調査制度
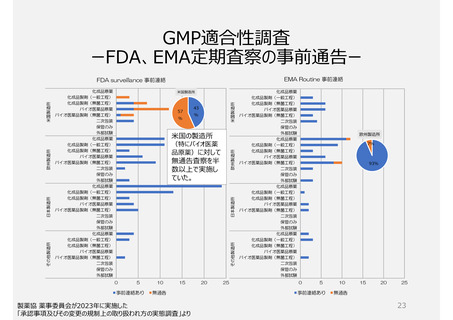
製造所のリスクに応じた調査要否判断や調査頻度を設定できる制度ではない。
承認前の調査は、承認申請品目に関係する全ての製造所について調査が行われるため、品目が異なれば低リスクで
あっても同じ製造所に短期間に繰返し調査が行われる場合がある。また、PMDAの実地調査率が低い。
製品の承認要件であることが製造所評価(実地調査)の妨げになっているのではないか。
参考)欧米では製造所のリスクに応じて調査頻度を変える制度が構築され、当局側が品目の承認前でも調査を不要とする場合がある。米国では
無通告による調査も多く行われる。一方、日本では品目の承認・維持のためGMP調査が必要な制度のため、企業からの申請による調査が
主である。このため無通告の調査が成立しにくい。製造所に対して適切な頻度で調査を行える制度とは言い難い。
3.
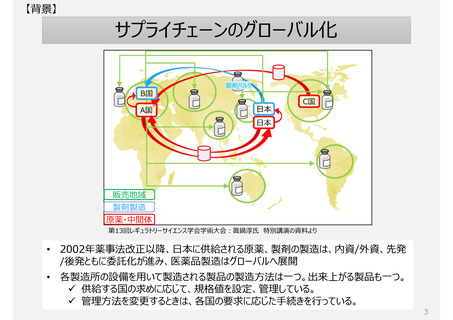
欧米薬局方(USP、Ph.Eur.)収載品の取扱い
各国で流通する欧米薬局方収載品であっても、日本で個別に審査・承認を経ないと製品出荷できないため、安定供
給に支障が生じる場合がある。
12
12
1.
日本の独自制度から生じる問題-詳細-
製造方法(規格及び試験方法等を含む)を変更する手続き制度
変更届出制度は、届出直後に変更の妥当性確認が行われないため、手続き間違いによる品質事案の発生を防ぐこと
が出来ない。また、変更届時と数年後に行われる変更の妥当性確認時で科学の進歩や見解の変化により、届出が不
適切と判断されてしまう場合がある。
参考)欧米は、高中低リスクの区分
日本の変更届出制度と同等制度とされている欧米の中低リスク変更のための届出手続きには、その手続きを行った際に手続きカテゴリと変
更内容の妥当性を当局が短時間で判断・審査が完了する仕組みがある。
承認事項(特に製造方法)
助詞を含め一言一句が承認事項となっている。ヒューマンエラーによる「誤記」も承認書の齟齬と扱われ、修正するため
にも薬事手続きを経る必要がある。(日本と欧米の製造方法の記載量・内容に特徴的な差はない)
承認申請時のリスク評価に基づき設定された、将来変更時の手続き区分を示す独特の記号を付すため、変更時点の
リスク評価により変更レベルが判断される欧米の変更手続きと異なる場合がある。
同じ変更でも日本の方が時間と手間がかかる対応が発生することがあり、出荷時期の予見性が低くなり、安定供給に
影響がでる
2.
GMP適合性調査制度
製造所のリスクに応じた調査要否判断や調査頻度を設定できる制度ではない。
承認前の調査は、承認申請品目に関係する全ての製造所について調査が行われるため、品目が異なれば低リスクで
あっても同じ製造所に短期間に繰返し調査が行われる場合がある。また、PMDAの実地調査率が低い。
製品の承認要件であることが製造所評価(実地調査)の妨げになっているのではないか。
参考)欧米では製造所のリスクに応じて調査頻度を変える制度が構築され、当局側が品目の承認前でも調査を不要とする場合がある。米国では
無通告による調査も多く行われる。一方、日本では品目の承認・維持のためGMP調査が必要な制度のため、企業からの申請による調査が
主である。このため無通告の調査が成立しにくい。製造所に対して適切な頻度で調査を行える制度とは言い難い。
3.
欧米薬局方(USP、Ph.Eur.)収載品の取扱い
各国で流通する欧米薬局方収載品であっても、日本で個別に審査・承認を経ないと製品出荷できないため、安定供
給に支障が生じる場合がある。
12
12