よむ、つかう、まなぶ。
薬-3○関係業界からの意見聴取について (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00073.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第209回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
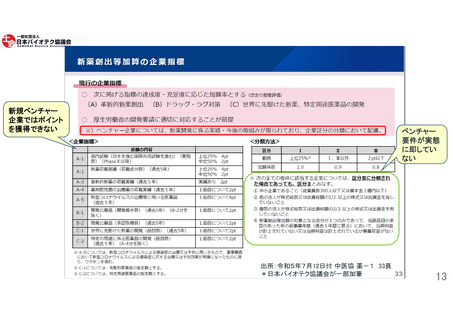
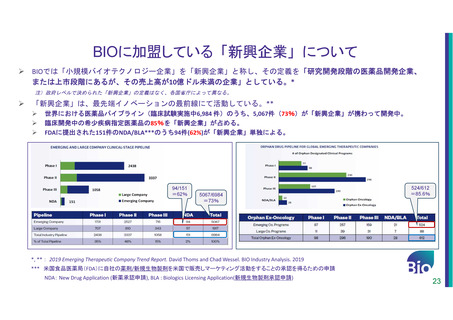
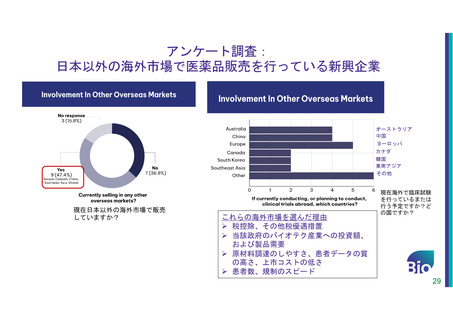
米国拠点新興企業の日本市場に対して感じている課題
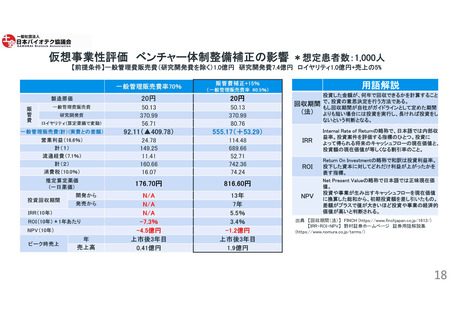
日本市場は薬事承認取得後、速やかに薬価が収載される点に魅力を感じる一方、以下の課題が挙げられる。
投資利益率(ROI)
断念した理由:上市のための先行投資費用と利益見通し(初期薬価設定から投資利益を得るまで)が障
壁。
例)上市した製品の収益を、次の製品の開発の原資にするため、収益(薬価)が重要。
医薬品開発から
海外市場に関する知識とリソースに乏しいベンチャー企業が開発するイノベーティブな
上市にかかる規制
薬剤に対する規制上の緩和が無い。
第3相試験および反復用量設定試験を含む規制要件に課題がある。
日本の制度は特に複雑で手続きもわかりにくく、先駆的医薬品指定制度などのメリットのある制度を
うまく活用するのが難しい。
米国又はグローバルなバイオテク産業が日本の規制を理解する場や機会が少ない。日本政府との
定期的な対話機会が少ない。
上市にかかる提携先
新興企業の多くは、単独で開発から上市まで行うには莫大なコストとリソースが必要と考えており、
医薬品開発・供給の初期段階として、日本企業との提携を開拓する必要があると考えているが、出
会いの場が必要とされる。
現状では出会いの場がないことから、新興企業にとって日本の開発環境は早期バイオテク
研究開発には適していないと感じている。
(BIOメンバーからの意見、アンケート調査及びヒアリング結果より)
25
日本市場は薬事承認取得後、速やかに薬価が収載される点に魅力を感じる一方、以下の課題が挙げられる。
投資利益率(ROI)
断念した理由:上市のための先行投資費用と利益見通し(初期薬価設定から投資利益を得るまで)が障
壁。
例)上市した製品の収益を、次の製品の開発の原資にするため、収益(薬価)が重要。
医薬品開発から
海外市場に関する知識とリソースに乏しいベンチャー企業が開発するイノベーティブな
上市にかかる規制
薬剤に対する規制上の緩和が無い。
第3相試験および反復用量設定試験を含む規制要件に課題がある。
日本の制度は特に複雑で手続きもわかりにくく、先駆的医薬品指定制度などのメリットのある制度を
うまく活用するのが難しい。
米国又はグローバルなバイオテク産業が日本の規制を理解する場や機会が少ない。日本政府との
定期的な対話機会が少ない。
上市にかかる提携先
新興企業の多くは、単独で開発から上市まで行うには莫大なコストとリソースが必要と考えており、
医薬品開発・供給の初期段階として、日本企業との提携を開拓する必要があると考えているが、出
会いの場が必要とされる。
現状では出会いの場がないことから、新興企業にとって日本の開発環境は早期バイオテク
研究開発には適していないと感じている。
(BIOメンバーからの意見、アンケート調査及びヒアリング結果より)
25