よむ、つかう、まなぶ。
【参考資料1】H27-29研究計画書(祖父江班) (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35321.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第13回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
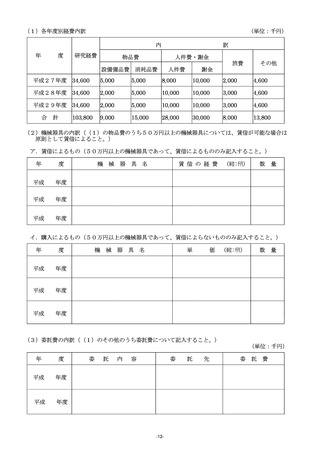
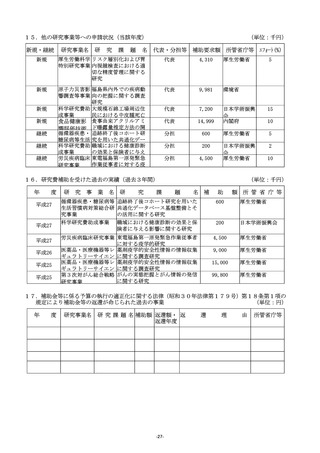
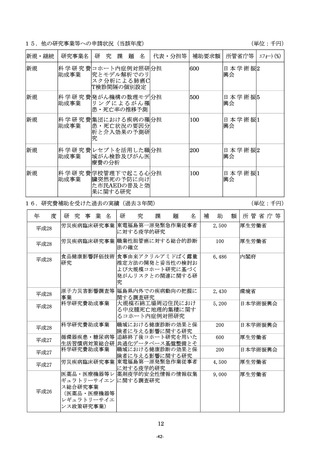
(2)複数年度にわたる研究の場合には、研究全体の計画と当該事業年度の計画との関係が分かるように記入
すること。
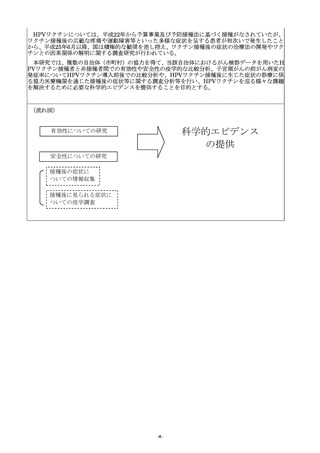
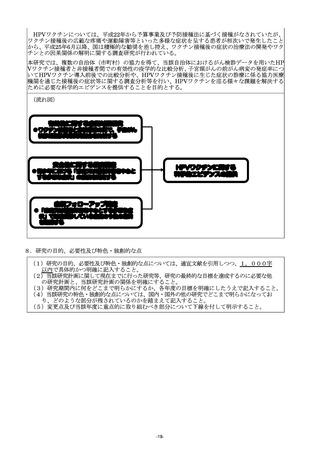
(3)研究の目的、方法及び期待される効果の流れ図を記入又は添付すること。
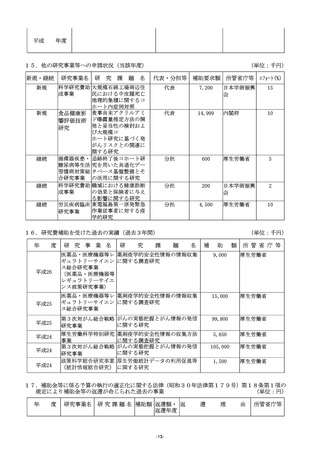
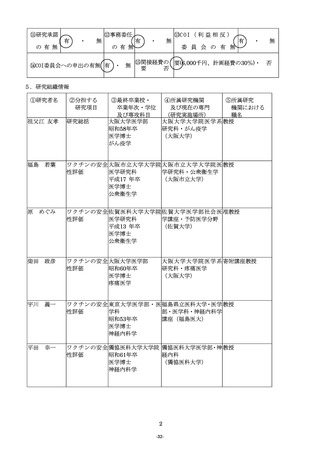
11.「8.研究の目的、必要性及び特色・独創的な点」について
(1)研究の目的、必要性及び特色・独創的な点については、適宜文献を引用しつつ、1,000字以内で具
体的かつ明確に記入すること。
(2)当該研究計画に関して現在までに行った研究等、研究の最終的な目標を達成するのに必要な他の研究計
画と、当該研究計画の関係を明確にすること。
(3)研究期間内に何をどこまで明らかにするか、各年度の目標を明確にしたうえで記入すること。
(4)当該研究の特色・独創的な点については、国内・国外の他の研究でどこまで明らかになっており、どの
ような部分が残されているのかを踏まえて記入すること。
(5)変更点及び当該年度に重点的に取り組むべき部分について下線を付して明示すること。
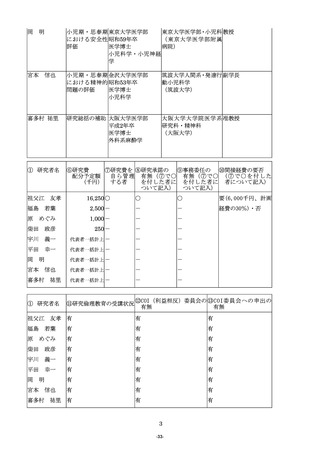
12.「9.期待される成果」について
(1) 期待される成果については、厚生労働行政の施策等への活用の可能性(施策への直接反映の可能性、政
策形成の過程等における参考として間接的に活用される可能性、間接的な波及効果等(民間での利活用(論
文引用等)、技術水準の向上、他の政策上有意な研究への発展性など)が期待できるか)を中心に600
字以内で記入すること。
(2) 当該研究がどのような厚生労働行政の課題に対し、どのように貢献するのか等について、その具体的な
内容や例を極力明確にすること。
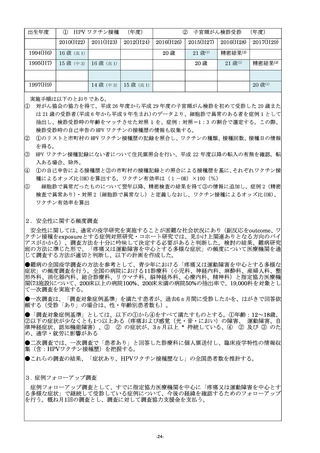
13.「10.当初の計画に照らした本研究事業の進捗状況」について
(1)当初の研究計画に照らした本研究事業の進捗状況については、本研究事業による前年度までの研究実績
が明らかになるように、当初の研究計画と比較しつつ、成果、進達度を明確に800字以内で記入するこ
と。
なお、研究の進捗により発表業績等がある場合には主なものを(2)により記載すること。
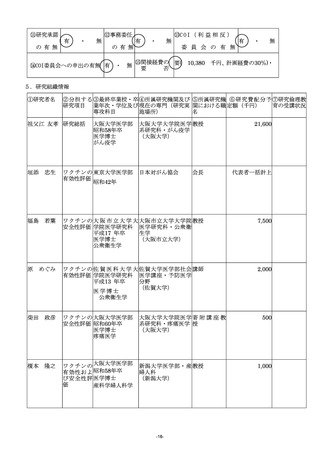
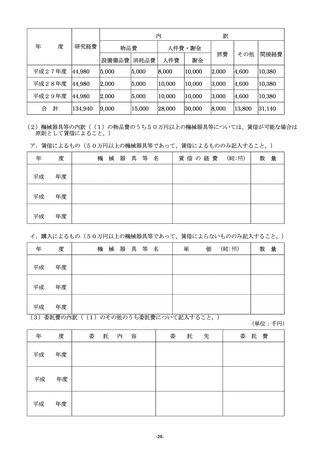
(2)発表業績等には研究代表者及び研究分担者ごとにそれぞれ学術雑誌等に発表した論文・著書のうち、主
なもの(過去3年間)を選択し、直近年度から順に記入すること。また、この研究に直接関連した論文・
著書については、著書氏名の名前に「○」を付すこと。
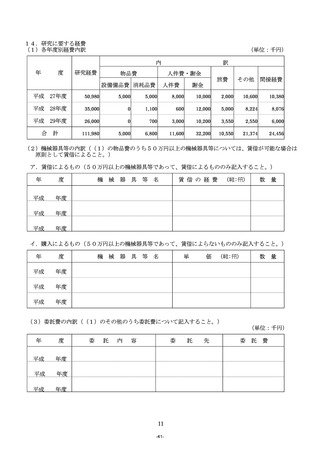
14.「11.研究計画・方法」について
(1)研究目的を達成するための具体的な研究計画及び方法を1,600字以内で記入すること。
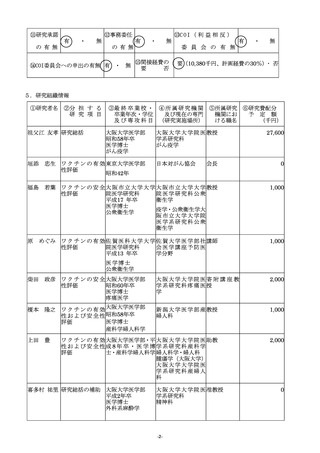
(2)研究計画を遂行するための研究体制について、研究代表者、研究分担者及び研究協力者の具体的な役割
を明確にすること。
(3)本研究を実施するために使用する研究施設・研究資料・研究フィールドの確保等、現在の研究環境の状
況を踏まえて記入すること。
(4)研究全体の計画と年次計画との関係がわかるように記入すること。
(5)研究の進捗状況が分かるように記入するとともに、変更点及び当該年度に重点的に取り組むべき部分に
ついて下線を付して明示すること。
(6)当該年度の研究計画・方法を明確に記入すること。
(7)臨床・疫学研究においては、基本デザイン、目標症例・試料数及び評価方法等を明確に記入すること。
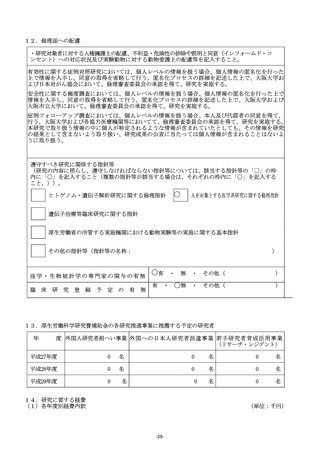
15.「12.倫理面への配慮」について
(1)「倫理面への配慮」には、研究対象者に対する人権擁護上の配慮、研究方法による研究対象者に対す
る不利益、危険性の排除や説明と同意(インフォームド・コンセント)に関わる状況、実験動物に対す
る動物愛護上の配慮などを必ず記入すること。倫理面の問題がないと判断した場合には、その旨記入す
るとともに必ず理由を明記すること。
なお、ヒトゲノム・遺伝子解析研究に関する倫理指針(平成25年文部科学省・厚生労働省・経済産
業省告示第1号)、人を対象とする医学系研究に関する倫理指針(平成26年文部科学省・厚生労働省
告示第3号)、遺伝子治療等臨床研究に関する指針(平成27年厚生労働省告示第344号)、、厚生労
働省の所管する実施機関における動物実験等の実施に関する基本指針(平成18年6月1日付厚生労働省
大臣官房厚生科学課長通知)及び申請者が所属する研究機関で定めた倫理規定等を遵守するとともに、あ
らかじめ当該研究機関の長等の承認、届出、確認等が必要な研究については、研究開始前に所定の手続を
行うこと。
(2)人又は動物を用いた研究を行う際に、事前に申請者の所属施設内の倫理委員会等において倫理面からの
審査を受けた場合には、審査内容を必ず添付すること。
(3)研究の内容に照らし、遵守しなければならない研究に関係する指針等については、該当する指針等の
「□」の枠内に「○」を記入すること(複数の指針等が該当する場合は、それぞれの枠内に「○」を記
入すること。)。
(4)「疫学・生物統計学の専門家の関与の有無」欄及び「臨床研究登録予定の有無」欄は、「有」又は「無」
のいずれか該当するものを「○」で囲むこと。ただし、当該研究の内容に関係がない場合は、「その他」
を「○」で囲むこと。
-29-
すること。
(3)研究の目的、方法及び期待される効果の流れ図を記入又は添付すること。
11.「8.研究の目的、必要性及び特色・独創的な点」について
(1)研究の目的、必要性及び特色・独創的な点については、適宜文献を引用しつつ、1,000字以内で具
体的かつ明確に記入すること。
(2)当該研究計画に関して現在までに行った研究等、研究の最終的な目標を達成するのに必要な他の研究計
画と、当該研究計画の関係を明確にすること。
(3)研究期間内に何をどこまで明らかにするか、各年度の目標を明確にしたうえで記入すること。
(4)当該研究の特色・独創的な点については、国内・国外の他の研究でどこまで明らかになっており、どの
ような部分が残されているのかを踏まえて記入すること。
(5)変更点及び当該年度に重点的に取り組むべき部分について下線を付して明示すること。
12.「9.期待される成果」について
(1) 期待される成果については、厚生労働行政の施策等への活用の可能性(施策への直接反映の可能性、政
策形成の過程等における参考として間接的に活用される可能性、間接的な波及効果等(民間での利活用(論
文引用等)、技術水準の向上、他の政策上有意な研究への発展性など)が期待できるか)を中心に600
字以内で記入すること。
(2) 当該研究がどのような厚生労働行政の課題に対し、どのように貢献するのか等について、その具体的な
内容や例を極力明確にすること。
13.「10.当初の計画に照らした本研究事業の進捗状況」について
(1)当初の研究計画に照らした本研究事業の進捗状況については、本研究事業による前年度までの研究実績
が明らかになるように、当初の研究計画と比較しつつ、成果、進達度を明確に800字以内で記入するこ
と。
なお、研究の進捗により発表業績等がある場合には主なものを(2)により記載すること。
(2)発表業績等には研究代表者及び研究分担者ごとにそれぞれ学術雑誌等に発表した論文・著書のうち、主
なもの(過去3年間)を選択し、直近年度から順に記入すること。また、この研究に直接関連した論文・
著書については、著書氏名の名前に「○」を付すこと。
14.「11.研究計画・方法」について
(1)研究目的を達成するための具体的な研究計画及び方法を1,600字以内で記入すること。
(2)研究計画を遂行するための研究体制について、研究代表者、研究分担者及び研究協力者の具体的な役割
を明確にすること。
(3)本研究を実施するために使用する研究施設・研究資料・研究フィールドの確保等、現在の研究環境の状
況を踏まえて記入すること。
(4)研究全体の計画と年次計画との関係がわかるように記入すること。
(5)研究の進捗状況が分かるように記入するとともに、変更点及び当該年度に重点的に取り組むべき部分に
ついて下線を付して明示すること。
(6)当該年度の研究計画・方法を明確に記入すること。
(7)臨床・疫学研究においては、基本デザイン、目標症例・試料数及び評価方法等を明確に記入すること。
15.「12.倫理面への配慮」について
(1)「倫理面への配慮」には、研究対象者に対する人権擁護上の配慮、研究方法による研究対象者に対す
る不利益、危険性の排除や説明と同意(インフォームド・コンセント)に関わる状況、実験動物に対す
る動物愛護上の配慮などを必ず記入すること。倫理面の問題がないと判断した場合には、その旨記入す
るとともに必ず理由を明記すること。
なお、ヒトゲノム・遺伝子解析研究に関する倫理指針(平成25年文部科学省・厚生労働省・経済産
業省告示第1号)、人を対象とする医学系研究に関する倫理指針(平成26年文部科学省・厚生労働省
告示第3号)、遺伝子治療等臨床研究に関する指針(平成27年厚生労働省告示第344号)、、厚生労
働省の所管する実施機関における動物実験等の実施に関する基本指針(平成18年6月1日付厚生労働省
大臣官房厚生科学課長通知)及び申請者が所属する研究機関で定めた倫理規定等を遵守するとともに、あ
らかじめ当該研究機関の長等の承認、届出、確認等が必要な研究については、研究開始前に所定の手続を
行うこと。
(2)人又は動物を用いた研究を行う際に、事前に申請者の所属施設内の倫理委員会等において倫理面からの
審査を受けた場合には、審査内容を必ず添付すること。
(3)研究の内容に照らし、遵守しなければならない研究に関係する指針等については、該当する指針等の
「□」の枠内に「○」を記入すること(複数の指針等が該当する場合は、それぞれの枠内に「○」を記
入すること。)。
(4)「疫学・生物統計学の専門家の関与の有無」欄及び「臨床研究登録予定の有無」欄は、「有」又は「無」
のいずれか該当するものを「○」で囲むこと。ただし、当該研究の内容に関係がない場合は、「その他」
を「○」で囲むこと。
-29-