よむ、つかう、まなぶ。
【資料3】(補足資料)小児用医薬品の開発促進に資する薬事審査等のあり方について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34601.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第2回 8/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
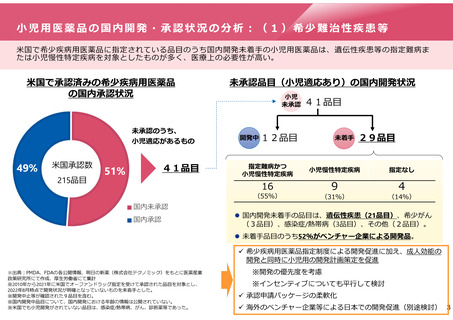
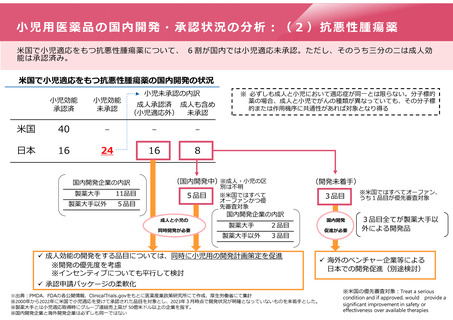
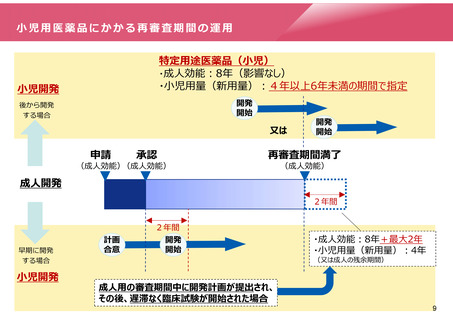
小児用医薬品にかかる再審査期間の運用
特定用途医薬品(小児)
・成人効能:8年(影響なし)
・小児用量(新用量):4年以上6年未満の期間で指定
小児開発
開発
開始
後から開発
する場合
又は
申請
承認
(成人効能)(成人効能)
開発
開始
再審査期間満了
(成人効能)
成人開発
2年間
2年間
早期に開発
する場合
小児開発
計画
合意
開発
開始
・成人効能:8年+最大2年
・小児用量(新用量):4年
(又は成人の残余期間)
成人用の審査期間中に開発計画が提出され、
その後、遅滞なく臨床試験が開始された場合
9
特定用途医薬品(小児)
・成人効能:8年(影響なし)
・小児用量(新用量):4年以上6年未満の期間で指定
小児開発
開発
開始
後から開発
する場合
又は
申請
承認
(成人効能)(成人効能)
開発
開始
再審査期間満了
(成人効能)
成人開発
2年間
2年間
早期に開発
する場合
小児開発
計画
合意
開発
開始
・成人効能:8年+最大2年
・小児用量(新用量):4年
(又は成人の残余期間)
成人用の審査期間中に開発計画が提出され、
その後、遅滞なく臨床試験が開始された場合
9