よむ、つかう、まなぶ。
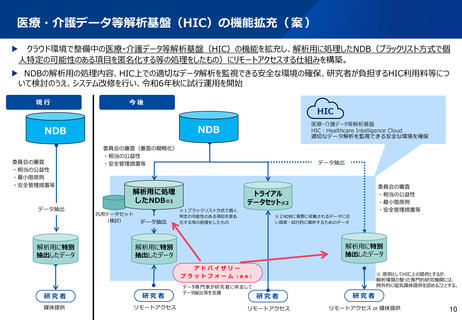
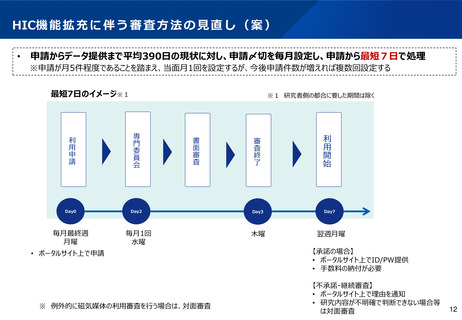
(資料1)医療・介護データ等解析基盤(HIC)の本格運用を見据えたNDBデータの利活用の更なる促進について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/index_00040.html |
| 出典情報 | 社会保障審議会 医療保険部会 匿名医療情報等の提供に関する専門委員会(第15回 4/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(参考)医療・介護・感染症対策WG議事録(抜粋)
○ 宮田教授 各種ヒアリングで提供までに1年ぐらいの時間を要するということで、これは世界的に見ても遅いと思います。そこはできるだけ時間が短縮されるよう
に、何かしら知恵を絞って頑張っていただきたいと思います。(知財について)その辺りも民間事業者のデータを使う場合は、きっと使えると思うのですけれども、
日本は医薬品開発が世界にかなり遅れているものもあると思うので、何かしら工夫をしてやってほしいということと、実際、使用用途目的についても、医薬品開
発というのは、どうしても営利的な側面もあるとは思うのですが、そこの線引きは難しいですし、最終的には公衆衛生にも寄与できるものになると思うので、今の
健保組合や製薬協さんのプレゼンのとおり、そこも柔軟にできるようにされるといいと思います。今、製薬業界は、希少疾患とか、難病の製品開発をすごく強く進
めている一方で、例えば各県に1人しかいないような希少疾患の患者さんのプライバシーが同定されるかもしれないという部分もリスクとして行政は考えていると
思うのですけれども、ただ、実際に難病の患者さんなどに私が話を聞くと、そもそも薬がないから、そうしたリスクは多少あっても、そういうものを使ってほしいという話
もあります。ゼロリスクは何事も難しいと思 うので、その辺りのベネフィットとリスクのバランスを取って、そこの部分もなるべく柔軟に使えるように工夫してもらえるとい
いと、常日頃、私も思っています。
○ 中室委員 申請からデータを使えるようになるまで330日かかって、これから改善をしても250日というのは、正気の沙汰とは思えない時間がかかっていると思い
ます。当然そこから分析するのに時間がかかるので、例えばコロナの状況などを分析しようと思ったら、データが来るまでに1年かかって、そこから仮に半年なり、1
年なり分析に時間がかかったら、2年かからないとコロナの分析はできないということなので、日本の研究者がコロナの分析を2年もたって発表していたら、世界
中からあほだと思われるのではないかと思います。なので、仮に改善が行われたとしても、250日というのは、全く論外の時間のかかり方だと思います。そう考える
と、海外はもっと短い時間で、多くの件数で出せているわけなので、現状の分析自体が間違っているというか、方向が違っているのではないかと思うのですけれど
も、私どものほうで調べてみましたら、例えばイギリスでは、イギリス政府が運営しているNHS Digitalなどが提供しているようなものですと、2010年からの利用実
績は3,000件以上ある。しかも、日本よりも短いスピードで出せているわけなので、どうして海外と同じようなスピード感と規模でやらないのかというところについて、
お伺いしたいと思います。
○ 印南専門委員 オープンデータ、サンプリングデータ、ダミーデータでも何でもいいのですが、これらは時系列的にはくっつかない仕組みになっていませんか。悉皆で
なくても、 コホートデータみたいに一定の人たちを匿名化した情報で時系列的に連結してあれば、割と短期間に分析できて、政策提言などに間に合うと思いま
す。そうでないと、理論的にくっつけることができなかったりすると、使い勝手が悪いと思います。政策提言に向けたデ ータ利用に対しては、毎年ランダムにサンプル
されてしまったりすると、むしろ意味がないと思います。パネルデータでないと意味がないのです。
○ 落合専門委員 インセンティブがないということですと、どうしても企業活動の中でそこにリソースを割くことが難しくなってくるかと思います。これは企業だけではなく
て、 研究者の方々であったとしても、何らかの可能性があることは重要だと思います。この部分については、政策的にどういうふうに考えていくか、適切に研究開
発を促進していくような取組をしていくのかどうかの判断に大きく関わるところだと思います。インセンティブ設計の点について見直しも考えていただきたいと思ってお
ります。もう一つは、要件に関する部分です。利用できる要件が厳しいということで、利用されていない部分があるのではないかと思っております。特に公益性につ
いて、判断ができるかどうか分からないことは重大な問題なのではないかと思っております。例えば創薬等の初期の探索的な研究から始まって、開発前のニーズ
調査であったり、副作用の分析、治療のアドヒアランスといったような、自社の医薬品の研究開発、安全性にわたるようなことも、どういう場合に利用できるのかを
5
より明確にして、利用しやすくすることが重要だと思います。
○ 宮田教授 各種ヒアリングで提供までに1年ぐらいの時間を要するということで、これは世界的に見ても遅いと思います。そこはできるだけ時間が短縮されるよう
に、何かしら知恵を絞って頑張っていただきたいと思います。(知財について)その辺りも民間事業者のデータを使う場合は、きっと使えると思うのですけれども、
日本は医薬品開発が世界にかなり遅れているものもあると思うので、何かしら工夫をしてやってほしいということと、実際、使用用途目的についても、医薬品開
発というのは、どうしても営利的な側面もあるとは思うのですが、そこの線引きは難しいですし、最終的には公衆衛生にも寄与できるものになると思うので、今の
健保組合や製薬協さんのプレゼンのとおり、そこも柔軟にできるようにされるといいと思います。今、製薬業界は、希少疾患とか、難病の製品開発をすごく強く進
めている一方で、例えば各県に1人しかいないような希少疾患の患者さんのプライバシーが同定されるかもしれないという部分もリスクとして行政は考えていると
思うのですけれども、ただ、実際に難病の患者さんなどに私が話を聞くと、そもそも薬がないから、そうしたリスクは多少あっても、そういうものを使ってほしいという話
もあります。ゼロリスクは何事も難しいと思 うので、その辺りのベネフィットとリスクのバランスを取って、そこの部分もなるべく柔軟に使えるように工夫してもらえるとい
いと、常日頃、私も思っています。
○ 中室委員 申請からデータを使えるようになるまで330日かかって、これから改善をしても250日というのは、正気の沙汰とは思えない時間がかかっていると思い
ます。当然そこから分析するのに時間がかかるので、例えばコロナの状況などを分析しようと思ったら、データが来るまでに1年かかって、そこから仮に半年なり、1
年なり分析に時間がかかったら、2年かからないとコロナの分析はできないということなので、日本の研究者がコロナの分析を2年もたって発表していたら、世界
中からあほだと思われるのではないかと思います。なので、仮に改善が行われたとしても、250日というのは、全く論外の時間のかかり方だと思います。そう考える
と、海外はもっと短い時間で、多くの件数で出せているわけなので、現状の分析自体が間違っているというか、方向が違っているのではないかと思うのですけれど
も、私どものほうで調べてみましたら、例えばイギリスでは、イギリス政府が運営しているNHS Digitalなどが提供しているようなものですと、2010年からの利用実
績は3,000件以上ある。しかも、日本よりも短いスピードで出せているわけなので、どうして海外と同じようなスピード感と規模でやらないのかというところについて、
お伺いしたいと思います。
○ 印南専門委員 オープンデータ、サンプリングデータ、ダミーデータでも何でもいいのですが、これらは時系列的にはくっつかない仕組みになっていませんか。悉皆で
なくても、 コホートデータみたいに一定の人たちを匿名化した情報で時系列的に連結してあれば、割と短期間に分析できて、政策提言などに間に合うと思いま
す。そうでないと、理論的にくっつけることができなかったりすると、使い勝手が悪いと思います。政策提言に向けたデ ータ利用に対しては、毎年ランダムにサンプル
されてしまったりすると、むしろ意味がないと思います。パネルデータでないと意味がないのです。
○ 落合専門委員 インセンティブがないということですと、どうしても企業活動の中でそこにリソースを割くことが難しくなってくるかと思います。これは企業だけではなく
て、 研究者の方々であったとしても、何らかの可能性があることは重要だと思います。この部分については、政策的にどういうふうに考えていくか、適切に研究開
発を促進していくような取組をしていくのかどうかの判断に大きく関わるところだと思います。インセンティブ設計の点について見直しも考えていただきたいと思ってお
ります。もう一つは、要件に関する部分です。利用できる要件が厳しいということで、利用されていない部分があるのではないかと思っております。特に公益性につ
いて、判断ができるかどうか分からないことは重大な問題なのではないかと思っております。例えば創薬等の初期の探索的な研究から始まって、開発前のニーズ
調査であったり、副作用の分析、治療のアドヒアランスといったような、自社の医薬品の研究開発、安全性にわたるようなことも、どういう場合に利用できるのかを
5
より明確にして、利用しやすくすることが重要だと思います。