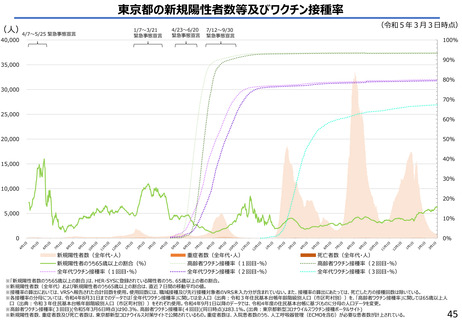
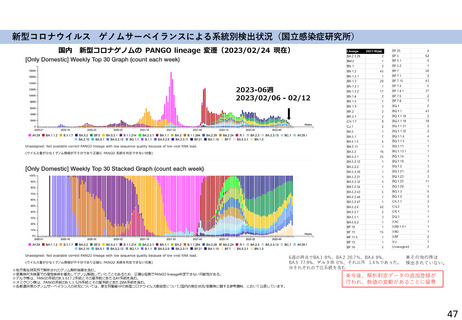
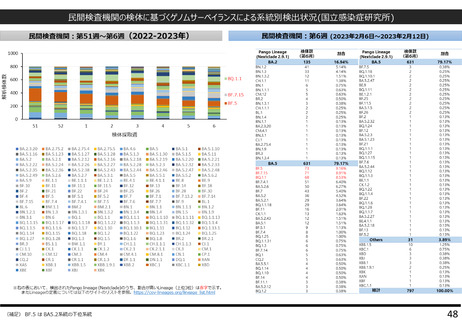
よむ、つかう、まなぶ。
資料2-1 直近の感染状況等について (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00395.html |
| 出典情報 | 新型コロナウイルス感染症対策アドバイザリーボード(第118回 3/8)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
中和抗体薬「ロナプリーブ」「ゼビュディ」について
1.治療薬の概要
ロナプリーブ注射液
(成分名:カシリビマブ/
イムデビマブ)
申請
企業
中外製薬
種別
中和抗体薬
投与
方法
単回点滴静注/単回
皮下投与
対象
患者
重症化リスク因子を有する軽症から中等症Ⅰの患者(酸素投
与を要する患者を除く。)
発症抑制の場合は、曝露後の免疫抑制状態の患者等
販売名
ゼビュディ点滴静注液
(成分名:ソトロビマブ)
申請
企業
グラクソ・スミスクライン
種別
中和抗体薬
投与
方法
単回点滴静注
対象
患者
重症化リスク因子を有する軽症から中等症Ⅰの患者(酸素
投与を要する患者を除く。)
販売名
令和3年9月6日薬事承認申請。9月27日薬事・食品衛生審議会、同日特例承認。
⚫
令和3年6月29日薬事承認申請。7月19日薬事・食品衛生審議会、同日特例承認。
⚫
曝露後の免疫抑制状態の患者等に対する発症抑制の適応拡大。(令和3年11月5日)
⚫
令和5年2月27日に添付文書が、「本剤の中和活性が低い SARS-CoV-2 変異株に対しては本剤の有効性が期待できない可能性があるため、SARS-CoV-2 の最新の流行株の情報を踏まえ、
⚫
最新のガイドライン等も参考に、本剤投与の適切性を検討すること。」と改訂され、日本感染症学会の「COVID-19 に対する薬物治療の考え方 第 15.1 版」(2023 年2月14 日)において、
「omicron 株 BA.2 系統、BA.5 系統、BQ.1 系統、XBB 系統の流行期には、抗ウイルス薬の投与を優先して検討する。」こととされた。
2.使用状況
(令和5年3月7日時点)
ロナプリーブ
ゼビュディ
投与者数(見込み)
約44,300人
約201,300人
登録医療機関数
約5,500施設
約5,700施設
約2,400施設
約4,200施設
うち納品実績のある医療機関数
3.取組状況
※日付は全て令和3年のもの
<ロナプリーブ>
⚫
都道府県の選定した医療機関に一定数を事前配布済み。(全都道府県
⚫
入院・宿泊療養施設(臨時の医療施設化等)や、病態悪化時の体制確
保など一定の要件を満たした医療機関での自宅療養者に対する外来
(8/25)、往診(9/17)での投与を実施。また、無床診療所の外来
においても投与を開始(9/28)。
⚫
に配付)
診療報酬を加算(外来投与(9/7、9/28)、往診投与(9/28))
<ゼビュディ>
⚫
9/28に配布開始
⚫
入院・宿泊療養施設(臨時の医療施設化等)や、有床診療所・病
院での自宅療養者に対する外来(11/5 )での投与を実施。また、
往診や、無床診療所の外来においても投与を開始(12/6)。
※
診療報酬はロナプリーブと同様
49
1.治療薬の概要
ロナプリーブ注射液
(成分名:カシリビマブ/
イムデビマブ)
申請
企業
中外製薬
種別
中和抗体薬
投与
方法
単回点滴静注/単回
皮下投与
対象
患者
重症化リスク因子を有する軽症から中等症Ⅰの患者(酸素投
与を要する患者を除く。)
発症抑制の場合は、曝露後の免疫抑制状態の患者等
販売名
ゼビュディ点滴静注液
(成分名:ソトロビマブ)
申請
企業
グラクソ・スミスクライン
種別
中和抗体薬
投与
方法
単回点滴静注
対象
患者
重症化リスク因子を有する軽症から中等症Ⅰの患者(酸素
投与を要する患者を除く。)
販売名
令和3年9月6日薬事承認申請。9月27日薬事・食品衛生審議会、同日特例承認。
⚫
令和3年6月29日薬事承認申請。7月19日薬事・食品衛生審議会、同日特例承認。
⚫
曝露後の免疫抑制状態の患者等に対する発症抑制の適応拡大。(令和3年11月5日)
⚫
令和5年2月27日に添付文書が、「本剤の中和活性が低い SARS-CoV-2 変異株に対しては本剤の有効性が期待できない可能性があるため、SARS-CoV-2 の最新の流行株の情報を踏まえ、
⚫
最新のガイドライン等も参考に、本剤投与の適切性を検討すること。」と改訂され、日本感染症学会の「COVID-19 に対する薬物治療の考え方 第 15.1 版」(2023 年2月14 日)において、
「omicron 株 BA.2 系統、BA.5 系統、BQ.1 系統、XBB 系統の流行期には、抗ウイルス薬の投与を優先して検討する。」こととされた。
2.使用状況
(令和5年3月7日時点)
ロナプリーブ
ゼビュディ
投与者数(見込み)
約44,300人
約201,300人
登録医療機関数
約5,500施設
約5,700施設
約2,400施設
約4,200施設
うち納品実績のある医療機関数
3.取組状況
※日付は全て令和3年のもの
<ロナプリーブ>
⚫
都道府県の選定した医療機関に一定数を事前配布済み。(全都道府県
⚫
入院・宿泊療養施設(臨時の医療施設化等)や、病態悪化時の体制確
保など一定の要件を満たした医療機関での自宅療養者に対する外来
(8/25)、往診(9/17)での投与を実施。また、無床診療所の外来
においても投与を開始(9/28)。
⚫
に配付)
診療報酬を加算(外来投与(9/7、9/28)、往診投与(9/28))
<ゼビュディ>
⚫
9/28に配布開始
⚫
入院・宿泊療養施設(臨時の医療施設化等)や、有床診療所・病
院での自宅療養者に対する外来(11/5 )での投与を実施。また、
往診や、無床診療所の外来においても投与を開始(12/6)。
※
診療報酬はロナプリーブと同様
49