よむ、つかう、まなぶ。
総-10-2○薬価算定の基準の改正について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00175.html |
| 出典情報 | 中央社会保険医療協議会 総会(第538回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
①
報告品目収載希望者、新キット収載希望者又は後発医薬品収載希望者は、
その製造販売する医療用医薬品が薬価基準に収載された場合は、特にやむを
得ない正当な理由がある場合を除き、その収載された日から3ヶ月以内に製
造販売して、当該医薬品の医療機関等への供給を開始するとともに、継続し
て供給するものとする。
② 報告品目収載希望者、新キット収載希望者又は後発医薬品収載希望者は、
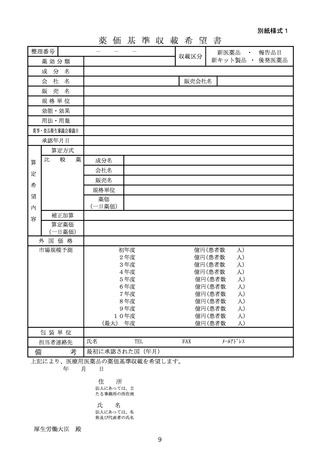
薬価基準に収載された医薬品について、別紙様式4に定める供給開始報告書
を提出すること。
3
再算定手続
薬価基準既収載品のうち、薬価改定の際に、「薬価算定の基準について」に規
定する市場拡大、効能変化又は用法用量変化に基づく再算定により薬価を改定す
ることとなる品目については、次の手順により再算定要件への該当性を検討し、
再算定品目を決定する。
(1) 薬価改定年の前年の薬価調査月の末日時点において市場拡大、効能変化又
は用法用量変化に基づく再算定の要件に該当すると考えられる品目については、
当該品目の製造販売業者から必要に応じ予め意見を聴取するとともに、別紙様
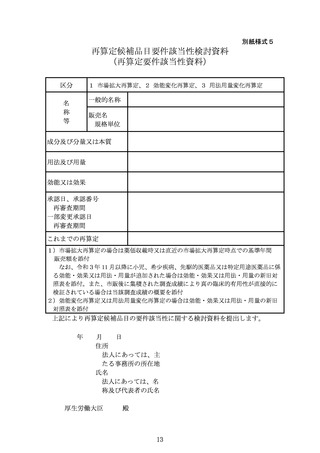
式5に定める再算定候補品目要件該当性検討資料(以下「再算定要件該当性資
料」という。)の提出を求める。
(2) 提出された再算定要件該当性資料に基づき、薬価算定組織の検討を経て再
算定の要件への該当性を検討し、再算定品目として適切と認められるものにつ
いては、中医協総会での審議の前に、意見を付して予め当該品目の製造販売業
者に通知する。
(3) 通知された再算定品目案について不服がある当該品目の製造販売業者は、
別紙様式6に定める再算定品目案不服意見書を別に指定する期限までに提出す
ることができる。この場合、通知された再算定品目案が適当ではないと主張す
る理由について「薬価算定の基準について」に基づいて説明する資料を根拠と
ともに添付する。
(4) 再算定品目案不服意見書を提出した製造販売業者は、予め定められた時間
の範囲内で薬価算定組織に出席して直接の意見表明を行うことができる。
この際、当該再算定候補品目の臨床試験に関与した者が当該製造販売業者に
同行して意見を表明することができる。
当該意見を踏まえ薬価算定組織において検討を行い、再度再算定品目案を決
定する。この再算定品目案を予め当該品目の製造販売業者に通知し、不服の有
無について確認する。
6
報告品目収載希望者、新キット収載希望者又は後発医薬品収載希望者は、
その製造販売する医療用医薬品が薬価基準に収載された場合は、特にやむを
得ない正当な理由がある場合を除き、その収載された日から3ヶ月以内に製
造販売して、当該医薬品の医療機関等への供給を開始するとともに、継続し
て供給するものとする。
② 報告品目収載希望者、新キット収載希望者又は後発医薬品収載希望者は、
薬価基準に収載された医薬品について、別紙様式4に定める供給開始報告書
を提出すること。
3
再算定手続
薬価基準既収載品のうち、薬価改定の際に、「薬価算定の基準について」に規
定する市場拡大、効能変化又は用法用量変化に基づく再算定により薬価を改定す
ることとなる品目については、次の手順により再算定要件への該当性を検討し、
再算定品目を決定する。
(1) 薬価改定年の前年の薬価調査月の末日時点において市場拡大、効能変化又
は用法用量変化に基づく再算定の要件に該当すると考えられる品目については、
当該品目の製造販売業者から必要に応じ予め意見を聴取するとともに、別紙様
式5に定める再算定候補品目要件該当性検討資料(以下「再算定要件該当性資
料」という。)の提出を求める。
(2) 提出された再算定要件該当性資料に基づき、薬価算定組織の検討を経て再
算定の要件への該当性を検討し、再算定品目として適切と認められるものにつ
いては、中医協総会での審議の前に、意見を付して予め当該品目の製造販売業
者に通知する。
(3) 通知された再算定品目案について不服がある当該品目の製造販売業者は、
別紙様式6に定める再算定品目案不服意見書を別に指定する期限までに提出す
ることができる。この場合、通知された再算定品目案が適当ではないと主張す
る理由について「薬価算定の基準について」に基づいて説明する資料を根拠と
ともに添付する。
(4) 再算定品目案不服意見書を提出した製造販売業者は、予め定められた時間
の範囲内で薬価算定組織に出席して直接の意見表明を行うことができる。
この際、当該再算定候補品目の臨床試験に関与した者が当該製造販売業者に
同行して意見を表明することができる。
当該意見を踏まえ薬価算定組織において検討を行い、再度再算定品目案を決
定する。この再算定品目案を予め当該品目の製造販売業者に通知し、不服の有
無について確認する。
6