よむ、つかう、まなぶ。
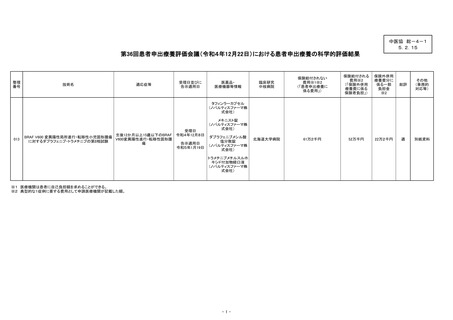
総-4-1○患者申出療養評価会議からの報告について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00175.html |
| 出典情報 | 中央社会保険医療協議会 総会(第538回 2/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
薬事承認申請までのロードマップ
実施医療機関からの申請資料
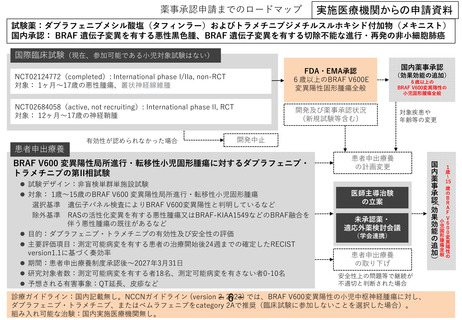
試験薬:ダブラフェニブメシル酸塩(タフィンラー)およびトラメチニブジメチルスルホキシド付加物(メキニスト)
国内承認: BRAF 遺伝子変異を有する悪性黒色腫、BRAF 遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌
国際臨床試験(現在、参加可能である小児対象試験はない)
FDA・EMA承認
6歳以上のBRAF V600E
変異陽性固形腫瘍全般
NCT02124772(completed): International phase I/IIa, non-RCT
対象: 1ヶ月〜17歳の悪性腫瘍、叢状神経線維腫
NCT02684058(active, not recruiting): International phase II, RCT
対象: 12ヶ月〜17歳の神経鞘腫
有効性が認められなかった場合
国内薬事承認
(効果効能の追加)
開発及び薬事承認状況
(新規試験等含む)
6歳以上の
BRAF V600変異陽性の
小児固形腫瘍全般
対象疾患や
年齢等の変更
開発中止
患者申出療養
BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・
トラメチニブの第II相試験
-6-
医師主導治験
の立案
未承認薬・
適応外薬検討会議
(学会連携)
患者申出療養
の取り下げ
安全性上の問題等で継続が
不適切と判断された場合
診療ガイドライン:国内記載無し。NCCNガイドライン (version 2. 2023) では、BRAF V600変異陽性の小児中枢神経腫瘍に対し、
ダブラフェニブ・トラメチニブ、またはベムラフェニブをcategory 2Aで推奨(臨床試験に参加しないことを選択した場合)。
組み入れ可能な治験:国内実施医療機関無し。
国 1
内 歳
薬 ~
15
事 歳
承 の
認 B
R
効 A
F
果 小V
効 児6
0
能固
0
形
の 腫変
異
追瘍
陽
全
加 般性
の
)
(
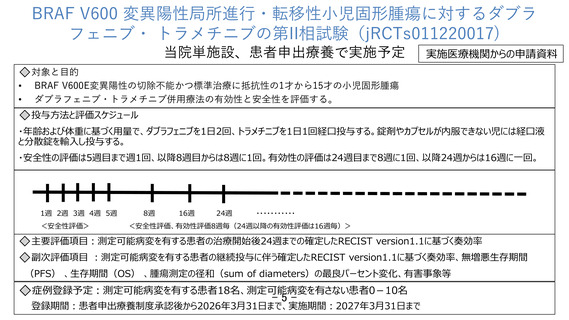
⚫ 試験デザイン:非盲検単群単施設試験
⚫ 対象: 1歳〜15歳のBRAF V600 変異陽性局所進行・転移性小児固形腫瘍
選択基準 遺伝子パネル検査によりBRAF V600変異陽性と判明しているなど
除外基準 RASの活性化変異を有する悪性腫瘍又はBRAF-KIAA1549などのBRAF融合を
伴う悪性腫瘍の既往があるなど
⚫ 目的:ダブラフェニブ・トラメチニブの有効性及び安全性の評価
⚫ 主要評価項目:測定可能病変を有する患者の治療開始後24週までの確定したRECIST
version1.1に基づく奏効率
⚫ 期間:患者申出療養制度承認後〜2027年3月31日
⚫ 研究対象者数:測定可能病変を有する者18名、測定可能病変を有さない者0-10名
⚫ 予想される有害事象:QT延長、皮疹など
患者申出療養
の計画変更
実施医療機関からの申請資料
試験薬:ダブラフェニブメシル酸塩(タフィンラー)およびトラメチニブジメチルスルホキシド付加物(メキニスト)
国内承認: BRAF 遺伝子変異を有する悪性黒色腫、BRAF 遺伝子変異を有する切除不能な進行・再発の非小細胞肺癌
国際臨床試験(現在、参加可能である小児対象試験はない)
FDA・EMA承認
6歳以上のBRAF V600E
変異陽性固形腫瘍全般
NCT02124772(completed): International phase I/IIa, non-RCT
対象: 1ヶ月〜17歳の悪性腫瘍、叢状神経線維腫
NCT02684058(active, not recruiting): International phase II, RCT
対象: 12ヶ月〜17歳の神経鞘腫
有効性が認められなかった場合
国内薬事承認
(効果効能の追加)
開発及び薬事承認状況
(新規試験等含む)
6歳以上の
BRAF V600変異陽性の
小児固形腫瘍全般
対象疾患や
年齢等の変更
開発中止
患者申出療養
BRAF V600 変異陽性局所進行・転移性小児固形腫瘍に対するダブラフェニブ・
トラメチニブの第II相試験
-6-
医師主導治験
の立案
未承認薬・
適応外薬検討会議
(学会連携)
患者申出療養
の取り下げ
安全性上の問題等で継続が
不適切と判断された場合
診療ガイドライン:国内記載無し。NCCNガイドライン (version 2. 2023) では、BRAF V600変異陽性の小児中枢神経腫瘍に対し、
ダブラフェニブ・トラメチニブ、またはベムラフェニブをcategory 2Aで推奨(臨床試験に参加しないことを選択した場合)。
組み入れ可能な治験:国内実施医療機関無し。
国 1
内 歳
薬 ~
15
事 歳
承 の
認 B
R
効 A
F
果 小V
効 児6
0
能固
0
形
の 腫変
異
追瘍
陽
全
加 般性
の
)
(
⚫ 試験デザイン:非盲検単群単施設試験
⚫ 対象: 1歳〜15歳のBRAF V600 変異陽性局所進行・転移性小児固形腫瘍
選択基準 遺伝子パネル検査によりBRAF V600変異陽性と判明しているなど
除外基準 RASの活性化変異を有する悪性腫瘍又はBRAF-KIAA1549などのBRAF融合を
伴う悪性腫瘍の既往があるなど
⚫ 目的:ダブラフェニブ・トラメチニブの有効性及び安全性の評価
⚫ 主要評価項目:測定可能病変を有する患者の治療開始後24週までの確定したRECIST
version1.1に基づく奏効率
⚫ 期間:患者申出療養制度承認後〜2027年3月31日
⚫ 研究対象者数:測定可能病変を有する者18名、測定可能病変を有さない者0-10名
⚫ 予想される有害事象:QT延長、皮疹など
患者申出療養
の計画変更