よむ、つかう、まなぶ。
【資料4-1】医薬・生活衛生局からの定期報告 (33 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30030.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第10回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
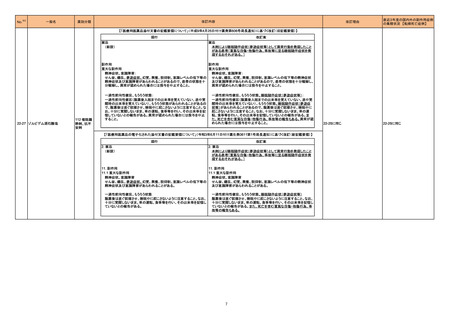
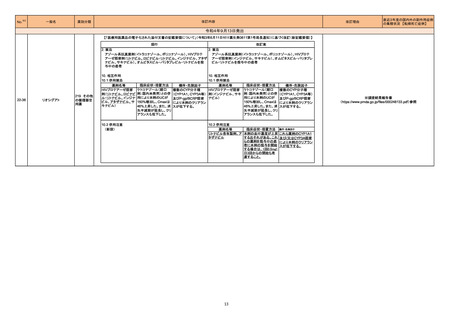
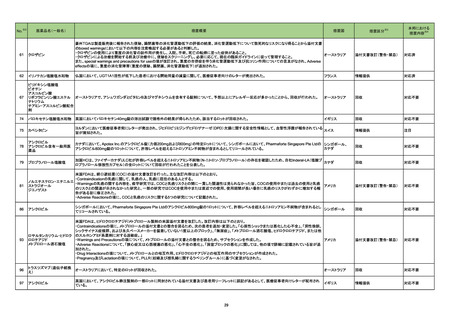
No.
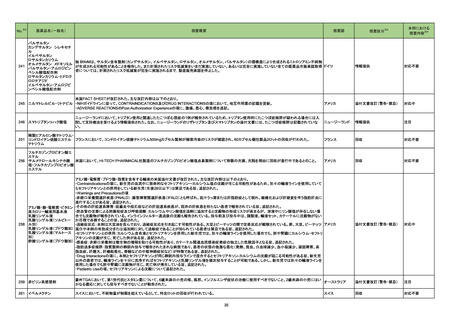
医薬品名(一般名)
208 モルヌピラビル
217
措置概要
※3
措置国
ニュージーランドMedsafeのウェブサイトに医療専門家向けレターが掲載されている。主な内容は以下のとおり。
・妊娠中のモルヌピラビルの使用は推奨されていない。
・性交経験のある妊娠する可能性のある女性への治療を開始する前に、妊娠検査の要否を検討すべきである。
・動物データに基づくと、モルヌピラビルは妊婦に投与された際に、胎児に害を及ぼす可能性がある。先天性欠損、流産、母体や胎児への有害な転帰のリスク
ニュージーランド
を評価するための、妊婦におけるモルヌピラビルの使用に関するデータはない。
・モルヌピラビル又はモルヌピラビルの代謝物のいずれかが母乳に移行するのか、母乳生産に影響を与えるのか、母乳で育てられている乳児に影響を与える
のかは、不明である。
・乳児に対する副作用の可能性に基づき、モルヌピラビル服用後4日間は授乳は推奨されない。
・生殖能を有する女性は治療期間中及び服用後4日間、男性は治療期間中及び服用後3ヵ月間、避妊するようアドバイスすること。
精製ヒアルロン酸ナトリウム
精製ヒアルロン酸ナトリウム・
ドイツにおいて、ヒアルロン酸ナトリウム眼粘弾剤製品の滅菌工程に逸脱が確認され製品の無菌性が保証されないため、一部のロットで回収が行われた。
コンドロイチン硫酸エステル
ナトリウム
措置区分
本邦における
措置内容※4
情報提供
対応済
ドイツ
回収
対応不要
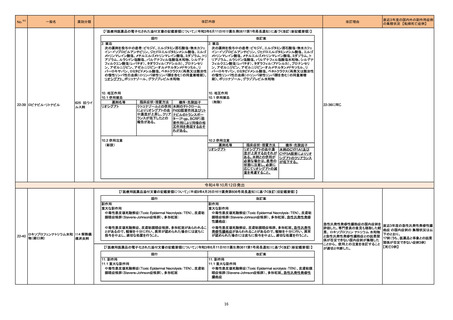
222 セフロキシム アキセチル
ブラジル、エクアドル、ペルー、スペイン及びベトナムにおいて、安定性が担保できない可能性があるとして、経口懸濁液の複数バッチが回収された。
ブラジル
回収
対応不要
223 セフロキシム アキセチル
マラウイ共和国において、配送中の温度監視装置の喪失が発覚したため、経口懸濁液及び錠剤の回収が行われた。
マラウイ
回収
対応不要
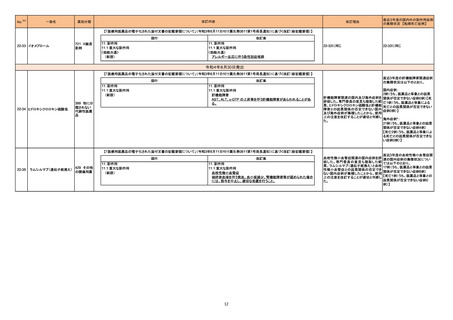
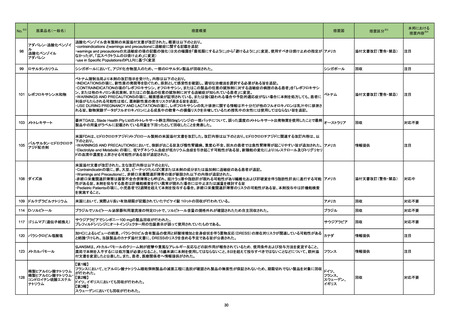
情報提供
対応不要
添付文書改訂(警告・禁忌)
注目
225
B型肝炎ウイルス表面抗原
キット
製造元における苦情調査の結果、特定ロットの中国向け製品において、一部のコンジュゲートボトルにマイクロパーティクルの試薬が入っていることが確認され
た。米国・中国以外の国向け製品でも同様の事象が発生している可能性がある。
問題の試薬カートリッジを使用した場合、反応混合物にコンジュゲートが分注されず、化学発光反応が行われないため非常に低い相対発効強度を示す。その
結果、キャリブレーションが成立しない、コントロールが低く管理範囲を外れる。コントロールの測定と試薬カートリッジ交換のタイミングによっては、コントールの
測定により検知されず、偽低値の結果が得られる可能性がある。
台湾、
顧客へ情報提供文書を提供し、以下の措置を通知した。
アメリカ、
- 直ちに対象ロットの使用を中止し、施設の手順に従い在庫分も含め廃棄すること。
中国
- 代替品を入手するため、カスタマーサポートに連絡すること。
- 検査医又は検査室長などと共に情報提供文書を確認し、施設の手順に従い、報告された患者検体の測定結果に対する再評価の必要性を判断すること。
- 対象ロットを他の施設へ提供した場合は、情報提供文書の内容について連絡し、コピーを提供すること。
- 返答書式に記入し、返送すること。
- 施設の手順に従い、情報提供文書を保管すること。
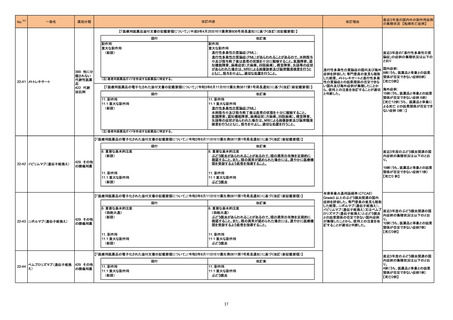
アミノ酸・電解質・ブドウ糖・脂質を含有する輸液の米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に、新生児の血流中に致命的なセフトリアキソンーカルシウム塩の沈殿が生じる可能性があるため、別々の輸液ラインを使用していて
もセフトリアキソンとの併用をしている新生児(生後28日以下)は禁忌である旨、追記された。
・Warnings and Precautionsの項
-非経口栄養関連肝疾患(PNALD):腸管障害関連肝疾患(IFALD)とも呼ばれ、胆汁うっ滞または肝脂肪症として現れ、線維化および肝硬変を伴う脂肪肝炎に
進行することがある旨、追記された。
-その他の肝胆道系障害:胆嚢炎や胆石症などの肝胆道系疾患が、既存の肝疾患を持たない患者で報告されている旨、追記された。
維持液
-肺血管の沈着による肺塞栓症及び呼吸困難:カルシウムやリン酸塩を過剰に添加すると沈殿物の形成リスクが高まるが、 溶液中にリン酸塩が存在しない場
乳酸リンゲル液
乳酸リンゲル液(マルトース 合でも沈殿物が報告されている。インラインフィルター通過後の沈殿も報告されている。投与前及び投与中は、調製液、輸液セット、カテーテルに沈殿物がない
加)
か目視で点検することの旨、追記された。
229 酢酸リンゲル液(ブドウ糖加) -過敏症反応:本剤は大豆油を含んでおり、過敏症反応を引き起こす可能性がある。大豆とピーナッツの間で交差反応が観察されている。卵、大豆、ピーナッツ アメリカ
維持液
蛋白や本剤の有効成分または添加剤に対して過敏症であることが知られている患者は禁忌である旨、追記された。
腹膜透析液
-セフトリアキソンとの併用:カルシウム含有液とセフトリアキソンを併用した新生児では、別々の輸液ラインを使用した場合でも、肺や腎臓にカルシウム・セフトリ
塩化カリウム、塩化ナトリウ アキソンの沈殿が生じ、死亡した例がある旨、追記された。
ム含有一般用医薬品
-感染症:非経口栄養剤は微生物の増殖を助ける可能性があり、カテーテル関連血流感染症発症の独立した危険因子となる旨、追記された。
-脂肪過多症候群:脂質製剤の静脈内投与で報告されたまれな病態であり、患者の状態の急激な悪化(発熱、貧血、白血球減少、血小板減少、凝固障害、高
脂血症、肝腫大、肝機能悪化、昏睡などの中枢神経症状など)が特徴である旨、追記された。
・Drug Interactionsの項に、本剤とセフトリアキソンが同じ静脈内投与ラインで混合するとセフトリアキソン-カルシウムの沈殿が起こる可能性がある旨、新生児
以外の患者では、輸液ラインを十分に洗浄すればセフトリアキソンと乳酸リンゲル液を順次投与することが可能である。しかし、新生児では別々の輸液ラインを
使用した場合でも肺や腎臓に沈殿物が生じ、死亡例が発生している旨、追記された。
・Pediatric Useの項、セフトリアキソンによる沈殿について追記された。
33
No.
医薬品名(一般名)
208 モルヌピラビル
217
措置概要
※3
措置国
ニュージーランドMedsafeのウェブサイトに医療専門家向けレターが掲載されている。主な内容は以下のとおり。
・妊娠中のモルヌピラビルの使用は推奨されていない。
・性交経験のある妊娠する可能性のある女性への治療を開始する前に、妊娠検査の要否を検討すべきである。
・動物データに基づくと、モルヌピラビルは妊婦に投与された際に、胎児に害を及ぼす可能性がある。先天性欠損、流産、母体や胎児への有害な転帰のリスク
ニュージーランド
を評価するための、妊婦におけるモルヌピラビルの使用に関するデータはない。
・モルヌピラビル又はモルヌピラビルの代謝物のいずれかが母乳に移行するのか、母乳生産に影響を与えるのか、母乳で育てられている乳児に影響を与える
のかは、不明である。
・乳児に対する副作用の可能性に基づき、モルヌピラビル服用後4日間は授乳は推奨されない。
・生殖能を有する女性は治療期間中及び服用後4日間、男性は治療期間中及び服用後3ヵ月間、避妊するようアドバイスすること。
精製ヒアルロン酸ナトリウム
精製ヒアルロン酸ナトリウム・
ドイツにおいて、ヒアルロン酸ナトリウム眼粘弾剤製品の滅菌工程に逸脱が確認され製品の無菌性が保証されないため、一部のロットで回収が行われた。
コンドロイチン硫酸エステル
ナトリウム
措置区分
本邦における
措置内容※4
情報提供
対応済
ドイツ
回収
対応不要
222 セフロキシム アキセチル
ブラジル、エクアドル、ペルー、スペイン及びベトナムにおいて、安定性が担保できない可能性があるとして、経口懸濁液の複数バッチが回収された。
ブラジル
回収
対応不要
223 セフロキシム アキセチル
マラウイ共和国において、配送中の温度監視装置の喪失が発覚したため、経口懸濁液及び錠剤の回収が行われた。
マラウイ
回収
対応不要
情報提供
対応不要
添付文書改訂(警告・禁忌)
注目
225
B型肝炎ウイルス表面抗原
キット
製造元における苦情調査の結果、特定ロットの中国向け製品において、一部のコンジュゲートボトルにマイクロパーティクルの試薬が入っていることが確認され
た。米国・中国以外の国向け製品でも同様の事象が発生している可能性がある。
問題の試薬カートリッジを使用した場合、反応混合物にコンジュゲートが分注されず、化学発光反応が行われないため非常に低い相対発効強度を示す。その
結果、キャリブレーションが成立しない、コントロールが低く管理範囲を外れる。コントロールの測定と試薬カートリッジ交換のタイミングによっては、コントールの
測定により検知されず、偽低値の結果が得られる可能性がある。
台湾、
顧客へ情報提供文書を提供し、以下の措置を通知した。
アメリカ、
- 直ちに対象ロットの使用を中止し、施設の手順に従い在庫分も含め廃棄すること。
中国
- 代替品を入手するため、カスタマーサポートに連絡すること。
- 検査医又は検査室長などと共に情報提供文書を確認し、施設の手順に従い、報告された患者検体の測定結果に対する再評価の必要性を判断すること。
- 対象ロットを他の施設へ提供した場合は、情報提供文書の内容について連絡し、コピーを提供すること。
- 返答書式に記入し、返送すること。
- 施設の手順に従い、情報提供文書を保管すること。
アミノ酸・電解質・ブドウ糖・脂質を含有する輸液の米国添付文書が改訂された。主な改訂内容は以下のとおり。
・Contraindicationsの項に、新生児の血流中に致命的なセフトリアキソンーカルシウム塩の沈殿が生じる可能性があるため、別々の輸液ラインを使用していて
もセフトリアキソンとの併用をしている新生児(生後28日以下)は禁忌である旨、追記された。
・Warnings and Precautionsの項
-非経口栄養関連肝疾患(PNALD):腸管障害関連肝疾患(IFALD)とも呼ばれ、胆汁うっ滞または肝脂肪症として現れ、線維化および肝硬変を伴う脂肪肝炎に
進行することがある旨、追記された。
-その他の肝胆道系障害:胆嚢炎や胆石症などの肝胆道系疾患が、既存の肝疾患を持たない患者で報告されている旨、追記された。
維持液
-肺血管の沈着による肺塞栓症及び呼吸困難:カルシウムやリン酸塩を過剰に添加すると沈殿物の形成リスクが高まるが、 溶液中にリン酸塩が存在しない場
乳酸リンゲル液
乳酸リンゲル液(マルトース 合でも沈殿物が報告されている。インラインフィルター通過後の沈殿も報告されている。投与前及び投与中は、調製液、輸液セット、カテーテルに沈殿物がない
加)
か目視で点検することの旨、追記された。
229 酢酸リンゲル液(ブドウ糖加) -過敏症反応:本剤は大豆油を含んでおり、過敏症反応を引き起こす可能性がある。大豆とピーナッツの間で交差反応が観察されている。卵、大豆、ピーナッツ アメリカ
維持液
蛋白や本剤の有効成分または添加剤に対して過敏症であることが知られている患者は禁忌である旨、追記された。
腹膜透析液
-セフトリアキソンとの併用:カルシウム含有液とセフトリアキソンを併用した新生児では、別々の輸液ラインを使用した場合でも、肺や腎臓にカルシウム・セフトリ
塩化カリウム、塩化ナトリウ アキソンの沈殿が生じ、死亡した例がある旨、追記された。
ム含有一般用医薬品
-感染症:非経口栄養剤は微生物の増殖を助ける可能性があり、カテーテル関連血流感染症発症の独立した危険因子となる旨、追記された。
-脂肪過多症候群:脂質製剤の静脈内投与で報告されたまれな病態であり、患者の状態の急激な悪化(発熱、貧血、白血球減少、血小板減少、凝固障害、高
脂血症、肝腫大、肝機能悪化、昏睡などの中枢神経症状など)が特徴である旨、追記された。
・Drug Interactionsの項に、本剤とセフトリアキソンが同じ静脈内投与ラインで混合するとセフトリアキソン-カルシウムの沈殿が起こる可能性がある旨、新生児
以外の患者では、輸液ラインを十分に洗浄すればセフトリアキソンと乳酸リンゲル液を順次投与することが可能である。しかし、新生児では別々の輸液ラインを
使用した場合でも肺や腎臓に沈殿物が生じ、死亡例が発生している旨、追記された。
・Pediatric Useの項、セフトリアキソンによる沈殿について追記された。
33