よむ、つかう、まなぶ。
総-3-2○医薬品の新規薬価収載について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00168.html |
| 出典情報 | 中央社会保険医療協議会 総会(第531回 11/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
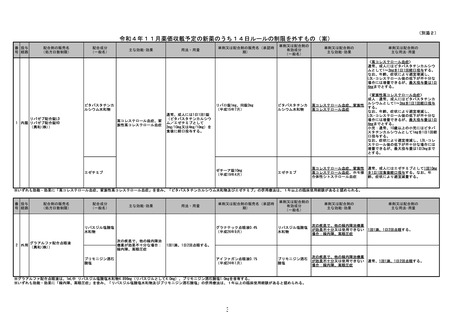
別添1
「コセルゴカプセル10mg及び同カプセル25mg」について
(1)疾患の特性
○
神経線維腫症1型における叢状神経線維腫は、主に学童期から発現が認め
られ、眼窩、顔面、上肢、下肢、背部等、様々な神経に沿って発生し、発現
部位により、外観上の変形、疼痛、運動機能障害、神経機能障害等の臨床症
状が生じ、生命維持に重要な器官を圧迫する場合には、生命を脅かす重度の
合併症につながる可能性がある。
〇
神経線維腫症1型における叢状神経線維腫治療の第一選択肢は外科切除で
あり、外科切除困難な叢状神経線維腫に対して承認された治療薬は本剤のみ
である。
(2)製剤上の特性
○
本剤は包装単位が28カプセル入りのボトルであり、吸湿性等の製剤の特
性上、PTP等の1カプセルごとの包装が技術的に不可能であることから、
ボトルのまま患者に渡すこととなるが、用法・用量上、減量が必要となる患
者では14日間で1ボトル使い切ることができない。
(参考)
用法及び用量:
通常、小児にはセルメチニブとして1回25mg/m2(体表面積)を1日2回空腹時に
経口投与するが、患者の状態により適宜減量する。ただし、1回量は50mgを上限と
する。
(3)14日を超える投薬における安全性
○
本剤は神経線維腫症1型患者を対象とした国内第Ⅰ相試験において、減量
に至った患者を含む全ての患者に対して14日間を超える投薬が行われ、当
該試験の結果より、安全性は許容可能であるとされていることから、14日
を超える投薬における安全性が確認されているといえる。
2
「コセルゴカプセル10mg及び同カプセル25mg」について
(1)疾患の特性
○
神経線維腫症1型における叢状神経線維腫は、主に学童期から発現が認め
られ、眼窩、顔面、上肢、下肢、背部等、様々な神経に沿って発生し、発現
部位により、外観上の変形、疼痛、運動機能障害、神経機能障害等の臨床症
状が生じ、生命維持に重要な器官を圧迫する場合には、生命を脅かす重度の
合併症につながる可能性がある。
〇
神経線維腫症1型における叢状神経線維腫治療の第一選択肢は外科切除で
あり、外科切除困難な叢状神経線維腫に対して承認された治療薬は本剤のみ
である。
(2)製剤上の特性
○
本剤は包装単位が28カプセル入りのボトルであり、吸湿性等の製剤の特
性上、PTP等の1カプセルごとの包装が技術的に不可能であることから、
ボトルのまま患者に渡すこととなるが、用法・用量上、減量が必要となる患
者では14日間で1ボトル使い切ることができない。
(参考)
用法及び用量:
通常、小児にはセルメチニブとして1回25mg/m2(体表面積)を1日2回空腹時に
経口投与するが、患者の状態により適宜減量する。ただし、1回量は50mgを上限と
する。
(3)14日を超える投薬における安全性
○
本剤は神経線維腫症1型患者を対象とした国内第Ⅰ相試験において、減量
に至った患者を含む全ての患者に対して14日間を超える投薬が行われ、当
該試験の結果より、安全性は許容可能であるとされていることから、14日
を超える投薬における安全性が確認されているといえる。
2