よむ、つかう、まなぶ。
資 料2 NATコントロールサーベイ事業2021年度 実績報告 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_28731.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第3回 10/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
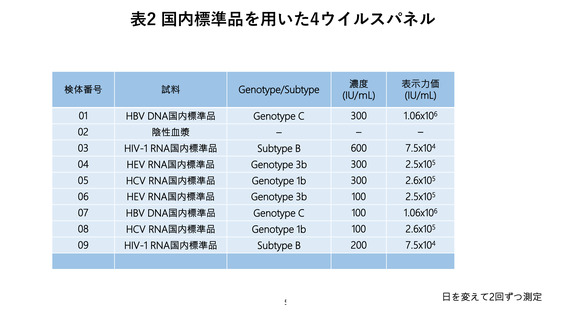
いた。HBV、HCV、HIV-1 については、輸血用血液の NAT で必要とされる検出限界値
(HBV: 100IU/mL, HCV: 100IU/mL, HIV-1: 200IU/mL) とその 3 倍濃度にあたる 300
IU/mL 或いは 600 IU/mL に検体を希釈調製した。HEV NAT については、輸血用血液
の NAT で必要とされる検出限界値はまだ設定されていないが、日本赤十字社の導入し
た検査システムの 95%分析感度は 3.6 IU/mL と極めて低いことを鑑み、HBV や HCV
と同様の 100 IU/mL とその 3 倍濃度にあたる 300 IU/mL に検体を希釈調製した。スク
リーニング試験用パネルとして 9 検体、及び同定試験用パネルとして 6 検体の計 15 検
体をブラインド化したパネルを参加施設に送付した。
3) 測定
輸血用血液製剤の NAT 実施施設と研究施設は Procleix UltrioPlex E ABD Assay (グ
リフォルス株式会社) を用いて測定した。この試験法は個別検体のスクリーニング試験
(HBV、HCV、HIV-1/2 を識別せず検出し、同時に HEV を単独で検出する) と HBV、
HCV、HIV-1/2 を識別するための同定試験とから構成されている。参加施設はスクリー
ニング試験と同定試験の両方の試験法を用いて、スクリーニング試験用パネル 9 検体及
び同定試験用パネル 6 検体に対してそれぞれ日を変えて 2 回ずつ測定した。
4) 結果
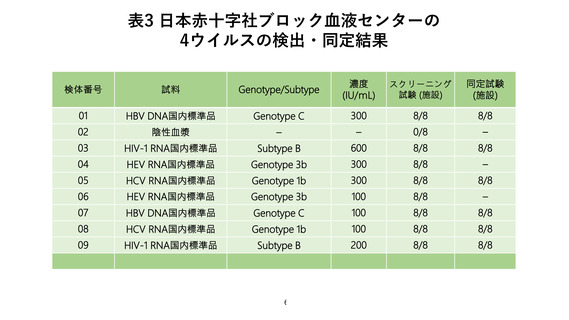
(1)輸血用血液製剤の NAT(表 3)
日本赤十字社ブロック血液センター全 8 施設において改正後の NAT ガイドラインに
基づいて実施している NAT 試験は、スクリーニング試験法と同定試験法の両方におい
て HBV、HCV、HIV-1、および HEV に関する精度管理が適切に実施されていた。全施
設において HBV、HCV、HIV-1、および HEV の検出限界値に希釈された検体およびそ
の 3 倍濃度に希釈された検体を全て検出できることを確認した。陰性対照は全て陰性と
判定された。
(2)研究施設および試薬メーカーにおける NAT
オブザーバーとして参加した研究施設および試薬メーカーにて実施されている NAT
試験は HBV、HCV、HIV-1、および HEV の検出限界値に希釈された検体およびその 3
倍濃度に希釈された検体を全て検出できることを確認した。陰性対照は全て陰性と判定
された。
3.考察
2021 年度に実施した HBV, HCV, HIV-1, HEV の 4 ウイルスパネルを用いた第 12
回 NAT コントロールサーベイにて、輸血用血液の NAT スクリーニング試験と同定試験
の両試験法において、HBV、HCV、HIV-1、および HEV の各ウイルスの陽性検体を問
題なく検出できることを確認できた。陰性対照は全て陰性と判定された。
2
(HBV: 100IU/mL, HCV: 100IU/mL, HIV-1: 200IU/mL) とその 3 倍濃度にあたる 300
IU/mL 或いは 600 IU/mL に検体を希釈調製した。HEV NAT については、輸血用血液
の NAT で必要とされる検出限界値はまだ設定されていないが、日本赤十字社の導入し
た検査システムの 95%分析感度は 3.6 IU/mL と極めて低いことを鑑み、HBV や HCV
と同様の 100 IU/mL とその 3 倍濃度にあたる 300 IU/mL に検体を希釈調製した。スク
リーニング試験用パネルとして 9 検体、及び同定試験用パネルとして 6 検体の計 15 検
体をブラインド化したパネルを参加施設に送付した。
3) 測定
輸血用血液製剤の NAT 実施施設と研究施設は Procleix UltrioPlex E ABD Assay (グ
リフォルス株式会社) を用いて測定した。この試験法は個別検体のスクリーニング試験
(HBV、HCV、HIV-1/2 を識別せず検出し、同時に HEV を単独で検出する) と HBV、
HCV、HIV-1/2 を識別するための同定試験とから構成されている。参加施設はスクリー
ニング試験と同定試験の両方の試験法を用いて、スクリーニング試験用パネル 9 検体及
び同定試験用パネル 6 検体に対してそれぞれ日を変えて 2 回ずつ測定した。
4) 結果
(1)輸血用血液製剤の NAT(表 3)
日本赤十字社ブロック血液センター全 8 施設において改正後の NAT ガイドラインに
基づいて実施している NAT 試験は、スクリーニング試験法と同定試験法の両方におい
て HBV、HCV、HIV-1、および HEV に関する精度管理が適切に実施されていた。全施
設において HBV、HCV、HIV-1、および HEV の検出限界値に希釈された検体およびそ
の 3 倍濃度に希釈された検体を全て検出できることを確認した。陰性対照は全て陰性と
判定された。
(2)研究施設および試薬メーカーにおける NAT
オブザーバーとして参加した研究施設および試薬メーカーにて実施されている NAT
試験は HBV、HCV、HIV-1、および HEV の検出限界値に希釈された検体およびその 3
倍濃度に希釈された検体を全て検出できることを確認した。陰性対照は全て陰性と判定
された。
3.考察
2021 年度に実施した HBV, HCV, HIV-1, HEV の 4 ウイルスパネルを用いた第 12
回 NAT コントロールサーベイにて、輸血用血液の NAT スクリーニング試験と同定試験
の両試験法において、HBV、HCV、HIV-1、および HEV の各ウイルスの陽性検体を問
題なく検出できることを確認できた。陰性対照は全て陰性と判定された。
2