よむ、つかう、まなぶ。
資料7-2 アナキンラにかかる開発要請について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00022.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第50回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
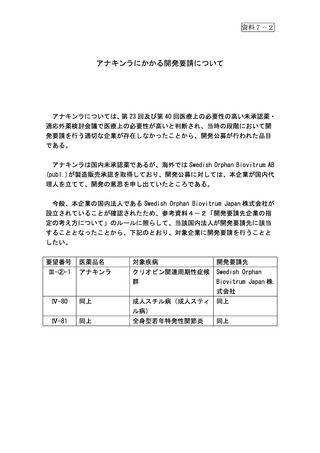
資料7-2
アナキンラにかかる開発要請について
アナキンラについては、第 23 回及び第 40 回医療上の必要性の高い未承認薬・
適応外薬検討会議で医療上の必要性が高いと判断され、当時の段階において開
発要請を行う適切な企業が存在しなかったことから、開発公募が行われた品目
である。
アナキンラは国内未承認薬であるが、海外では Swedish Orphan Biovitrum AB
(publ.)が製造販売承認を取得しており、開発公募に対しては、本企業が国内代
理人を立てて、開発の意思を申し出ていたところである。
今般、本企業の国内法人である Swedish Orphan Biovitrum Japan 株式会社が
設立されていることが確認されたため、参考資料4-2「開発要請先企業の指
定の考え方について」のルールに照らして、当該国内法人が開発要請先に該当
することとなったことから、下記のとおり、対象企業に開発要請を行うことと
したい。
要望番号
医薬品名
対象疾病
開発要請先
アナキンラ
クリオピン関連周期性症候
群
Swedish Orphan
Biovitrum Japan 株
式会社
Ⅳ-80
同上
成人スチル病(成人スティ
ル病)
同上
Ⅳ-81
同上
全身型若年特発性関節炎
同上
Ⅲ-②-1
アナキンラにかかる開発要請について
アナキンラについては、第 23 回及び第 40 回医療上の必要性の高い未承認薬・
適応外薬検討会議で医療上の必要性が高いと判断され、当時の段階において開
発要請を行う適切な企業が存在しなかったことから、開発公募が行われた品目
である。
アナキンラは国内未承認薬であるが、海外では Swedish Orphan Biovitrum AB
(publ.)が製造販売承認を取得しており、開発公募に対しては、本企業が国内代
理人を立てて、開発の意思を申し出ていたところである。
今般、本企業の国内法人である Swedish Orphan Biovitrum Japan 株式会社が
設立されていることが確認されたため、参考資料4-2「開発要請先企業の指
定の考え方について」のルールに照らして、当該国内法人が開発要請先に該当
することとなったことから、下記のとおり、対象企業に開発要請を行うことと
したい。
要望番号
医薬品名
対象疾病
開発要請先
アナキンラ
クリオピン関連周期性症候
群
Swedish Orphan
Biovitrum Japan 株
式会社
Ⅳ-80
同上
成人スチル病(成人スティ
ル病)
同上
Ⅳ-81
同上
全身型若年特発性関節炎
同上
Ⅲ-②-1