よむ、つかう、まなぶ。
資料3 抗がんWG (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00022.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第50回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
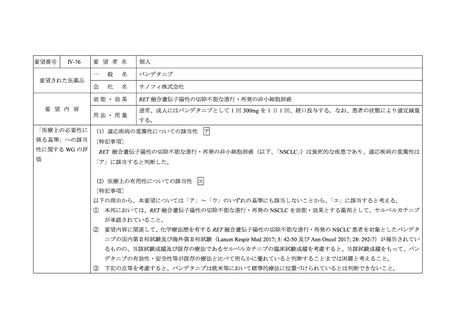
要望番号
Ⅳ-76
要 望 者 名
個人
一
般
名
バンデタニブ
会
社
名
サノフィ株式会社
要望された医薬品
効能・効果
要 望 内 容
用法・用量
RET 融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌
通常、成人にはバンデタニブとして 1 回 300mg を 1 日 1 回、経口投与する。なお、患者の状態により適宜減量
する。
「医療上の必要性に (1)適応疾病の重篤性についての該当性
係る基準」への該当 〔特記事項〕
性に関する WG の評
価
ア
RET 融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌(以下、「NSCLC」)は致死的な疾患であり、適応疾病の重篤性は
「ア」に該当すると判断した。
(2)医療上の有用性についての該当性
エ
〔特記事項〕
以下の理由から、本要望については「ア」~「ウ」のいずれの基準にも該当しないことから、
「エ」に該当すると考える。
① 本邦においては、RET 融合遺伝子陽性の切除不能な進行・再発の NSCLC を効能・効果とする薬剤として、セルペルカチニブ
が承認されていること。
② 要望内容に関連して、化学療法歴を有する RET 融合遺伝子陽性の切除不能な進行・再発の NSCLC 患者を対象としたバンデタ
ニブの国内第Ⅱ相試験及び海外第Ⅱ相試験(Lancet Respir Med 2017; 5: 42-50 及び Ann Oncol 2017; 28: 292-7)が報告されてい
るものの、当該試験成績及び既存の療法であるセルペルカチニブの臨床試験成績を考慮すると、当該試験成績をもって、バン
デタニブの有効性・安全性等が既存の療法と比べて明らかに優れていると判断することまでは困難と考えること。
③ 下記の点等を考慮すると、バンデタニブは欧米等において標準的療法に位置づけられているとは判断できないこと。
Ⅳ-76
要 望 者 名
個人
一
般
名
バンデタニブ
会
社
名
サノフィ株式会社
要望された医薬品
効能・効果
要 望 内 容
用法・用量
RET 融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌
通常、成人にはバンデタニブとして 1 回 300mg を 1 日 1 回、経口投与する。なお、患者の状態により適宜減量
する。
「医療上の必要性に (1)適応疾病の重篤性についての該当性
係る基準」への該当 〔特記事項〕
性に関する WG の評
価
ア
RET 融合遺伝子陽性の切除不能な進行・再発の非小細胞肺癌(以下、「NSCLC」)は致死的な疾患であり、適応疾病の重篤性は
「ア」に該当すると判断した。
(2)医療上の有用性についての該当性
エ
〔特記事項〕
以下の理由から、本要望については「ア」~「ウ」のいずれの基準にも該当しないことから、
「エ」に該当すると考える。
① 本邦においては、RET 融合遺伝子陽性の切除不能な進行・再発の NSCLC を効能・効果とする薬剤として、セルペルカチニブ
が承認されていること。
② 要望内容に関連して、化学療法歴を有する RET 融合遺伝子陽性の切除不能な進行・再発の NSCLC 患者を対象としたバンデタ
ニブの国内第Ⅱ相試験及び海外第Ⅱ相試験(Lancet Respir Med 2017; 5: 42-50 及び Ann Oncol 2017; 28: 292-7)が報告されてい
るものの、当該試験成績及び既存の療法であるセルペルカチニブの臨床試験成績を考慮すると、当該試験成績をもって、バン
デタニブの有効性・安全性等が既存の療法と比べて明らかに優れていると判断することまでは困難と考えること。
③ 下記の点等を考慮すると、バンデタニブは欧米等において標準的療法に位置づけられているとは判断できないこと。