よむ、つかう、まなぶ。
資料3-1 代謝・その他WG (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00024.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第52回 8/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
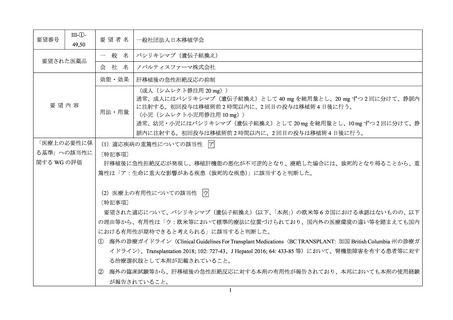
要望番号
III-①49,50
要望された医薬品
要望者名
一般社団法人日本移植学会
一
般
名
バシリキシマブ(遺伝子組換え)
会
社
名
ノバルティスファーマ株式会社
効能・効果
肝移植後の急性拒絶反応の抑制
要望内容
用法・用量
〈成人(シムレクト静注用 20 mg)〉
通常、成人にはバシリキシマブ(遺伝子組換え)として 40 mg を総用量とし、20 mg ずつ 2 回に分けて、静脈内
に注射する。初回投与は移植術前 2 時間以内に、2 回目の投与は移植術 4 日後に行う。
〈小児(シムレクト小児用静注用 10 mg)〉
通常、幼児・小児にはバシリキシマブ(遺伝子組換え)として 20 mg を総用量とし、10 mg ずつ 2 回に分けて、静
脈内に注射する。初回投与は移植術前 2 時間以内に、2 回目の投与は移植術 4 日後に行う。
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
肝移植後に急性拒絶反応が発現し、移植肝機能の悪化が不可逆的となり、廃絶した場合には、致死的となり得ることから、重
篤性は「ア:生命に重大な影響がある疾患(致死的な疾患)
」に該当すると判断した。
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
要望された適応について、バシリキシマブ(遺伝子組換え)
(以下、
「本剤」
)の欧米等 6 カ国における承認はないものの、以下
の理由等から、有用性は「ウ:欧米等において標準的療法に位置づけられており、国内外の医療環境の違い等を踏まえても国内
における有用性が期待できると考えられる」に該当すると判断した。
① 海外の診療ガイドライン(Clinical Guidelines For Transplant Medications〈BC TRANSPLANT: 加国 British Columbia 州の診療ガ
イドライン〉、Transplantation 2018; 102: 727-43、J Hepatol 2016; 64: 433-85 等)において、腎機能障害を有する患者等に対す
る治療選択肢として本剤が記載されていること。
② 海外の臨床試験等から、肝移植後の急性拒絶反応に対する本剤の有用性が報告されており、本邦においても本剤の使用経験
が報告されていること。
1
III-①49,50
要望された医薬品
要望者名
一般社団法人日本移植学会
一
般
名
バシリキシマブ(遺伝子組換え)
会
社
名
ノバルティスファーマ株式会社
効能・効果
肝移植後の急性拒絶反応の抑制
要望内容
用法・用量
〈成人(シムレクト静注用 20 mg)〉
通常、成人にはバシリキシマブ(遺伝子組換え)として 40 mg を総用量とし、20 mg ずつ 2 回に分けて、静脈内
に注射する。初回投与は移植術前 2 時間以内に、2 回目の投与は移植術 4 日後に行う。
〈小児(シムレクト小児用静注用 10 mg)〉
通常、幼児・小児にはバシリキシマブ(遺伝子組換え)として 20 mg を総用量とし、10 mg ずつ 2 回に分けて、静
脈内に注射する。初回投与は移植術前 2 時間以内に、2 回目の投与は移植術 4 日後に行う。
「医療上の必要性に係 (1)適応疾病の重篤性についての該当性
る基準」への該当性に 〔特記事項〕
関する WG の評価
ア
肝移植後に急性拒絶反応が発現し、移植肝機能の悪化が不可逆的となり、廃絶した場合には、致死的となり得ることから、重
篤性は「ア:生命に重大な影響がある疾患(致死的な疾患)
」に該当すると判断した。
(2)医療上の有用性についての該当性
ウ
〔特記事項〕
要望された適応について、バシリキシマブ(遺伝子組換え)
(以下、
「本剤」
)の欧米等 6 カ国における承認はないものの、以下
の理由等から、有用性は「ウ:欧米等において標準的療法に位置づけられており、国内外の医療環境の違い等を踏まえても国内
における有用性が期待できると考えられる」に該当すると判断した。
① 海外の診療ガイドライン(Clinical Guidelines For Transplant Medications〈BC TRANSPLANT: 加国 British Columbia 州の診療ガ
イドライン〉、Transplantation 2018; 102: 727-43、J Hepatol 2016; 64: 433-85 等)において、腎機能障害を有する患者等に対す
る治療選択肢として本剤が記載されていること。
② 海外の臨床試験等から、肝移植後の急性拒絶反応に対する本剤の有用性が報告されており、本邦においても本剤の使用経験
が報告されていること。
1