よむ、つかう、まなぶ。
参考資料2:体外診断用医薬品の一般検査薬への転用について(平成26年12月25日付け薬食発1225第1号厚生労働省医薬食品局長通知) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27434.html |
| 出典情報 | 薬事・食品衛生審議会 医療機器・体外診断薬部会(令和4年度第4回 8/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
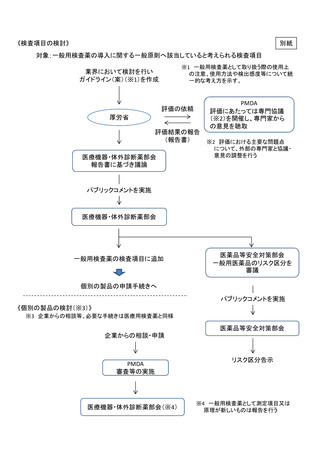
(2)個別の製品の検討
機構において、医療用の体外診断用医薬品と同様の手続きにより、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和 35年法律第 145 号)に基づく承認審査を行うこと。なお、機構における相談は、相談内容に応じ医療用の体外診断用医薬品と同様の相談区分で実施することとすること。また、標準的審査期間については、検査項目に応じた精度が求められることから、医療用の体外診断用医薬品と同様の取扱いとすること(平成 26 年3月 31 日に公表された「体外診断用医薬品審査迅速化のための協働計画」に基づき、原則、通常品目※として取り扱う)。
※ 通常品目は、申請から承認までの標準的な総審査期間について、平成30 年度までに申請コホートにおける 80%タイル値で7ヶ月の期間目標を達成する。
3
すでに転用が認められている一般用検査薬について
2にかかわらず、ヒトの尿を検体とし、糖、タンパク及び絨毛性性腺刺激ホルモン(hCG)についての検出又は測定を行うものは、一般用検査薬として承認又は認証の申請が認められること。なお、これらの検査項目について承認又は認証の申請を行う場合であっても、別添1の一般原則に従うことが望ましいこと。
機構において、医療用の体外診断用医薬品と同様の手続きにより、医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(昭和 35年法律第 145 号)に基づく承認審査を行うこと。なお、機構における相談は、相談内容に応じ医療用の体外診断用医薬品と同様の相談区分で実施することとすること。また、標準的審査期間については、検査項目に応じた精度が求められることから、医療用の体外診断用医薬品と同様の取扱いとすること(平成 26 年3月 31 日に公表された「体外診断用医薬品審査迅速化のための協働計画」に基づき、原則、通常品目※として取り扱う)。
※ 通常品目は、申請から承認までの標準的な総審査期間について、平成30 年度までに申請コホートにおける 80%タイル値で7ヶ月の期間目標を達成する。
3
すでに転用が認められている一般用検査薬について
2にかかわらず、ヒトの尿を検体とし、糖、タンパク及び絨毛性性腺刺激ホルモン(hCG)についての検出又は測定を行うものは、一般用検査薬として承認又は認証の申請が認められること。なお、これらの検査項目について承認又は認証の申請を行う場合であっても、別添1の一般原則に従うことが望ましいこと。