よむ、つかう、まなぶ。
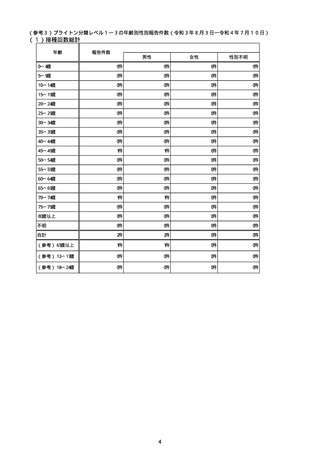
資料1-5-3 新型コロナワクチン接種後のTTS疑いとして報告された事例の概要(バキスゼブリア筋注) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00046.html |
| 出典情報 | 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第8回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(8/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
【別紙1】
新型コロナワクチン接種後の血小板減少症を伴う血栓症疑いとして製造販売業者から報告された事例の一覧
(バキスゼブリア筋注、アストラゼネカ株式会社)
(令和3年8月3日から令和4年7月10日までの報告分)
※評価記号
α:「ワクチンと症状名との因果関係が否定できないもの」
原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、ワクチン接種が、事象発現の原因となったことが否定できない症例
β:「ワクチンと症状名との因果関係が認められないもの」
原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、ワクチン接種が、事象発現の原因となったとは認められない症例
γ:「情報不足等によりワクチンと症状名との因果関係が評価できないもの」
情報が十分でない、使用目的又は方法が適正でない等のためワクチン接種と事象発現との因果関係の評価ができない症例
注:「No」は、全新型コロナワクチンに係る副反応疑い報告(製造販売業者からの報告)の通番。
$
No
年齢
性別
接種日
発生日
$
接種から
発生までの
日数
ワクチン名
2022年7月10日現在
製造販売業者
ロット番号 接種回数
基礎疾患等
症状名(PT名)
転帰日
転帰内容
専門家の
因果関係評価
専門家の評価PT
専門家の
ブライトン分類レベ
ル
専門家の意見
備考
血小板減少を認めます。血液疾患の既往
を判断するために接種前の血小板の値が
欲しいところですが、
最終的に回復した値を参考に接種後に新
たに発生した血小板減少であることが推
測可能であると考えます。
造影CTによる画像所見において血栓症
(静脈洞、門脈内)が確認されていま
す。
23302 48歳 男性
2021/09/03
2021/09/04
2021/09/18
1 バキスゼブリア筋注
アストラゼネカ
K004C
1回目
タバコ使用者;
TTS(血小板減少症を伴う血栓症)
2021/10/01
肥満
末梢血管塞栓症(末梢血管塞栓症)
2021
後遺症あり
回復
血小板減少症を伴う血栓症
α
1
検査値異常(Dダイマーの著増)を認め
ます。
上記に加え、抗PF4抗体(ELISA法)が
陽性であることが確認され、
TMA(TTP, HUS)、DICを除外するため
の検査所見が得られてはいないものの、
臨床上バキスゼブリア投与による既知の
副反応であるTTSを発症したと判断する
ことが可能です。
以上より、本症例の因果関係を「因果関
係は否定できない」と評価します。
新たな血小板減少の発症及び血栓症/血
栓塞栓症の存在(造影CTによる画像所見
において、血栓症(上腸間膜動脈閉塞症
等)あり)がいずれも確認されていま
す。
ワクチン接種後から28日以上が経過して
いること、その他の血小板減少をきたす
23313 70歳 男性
2021/09/18
2021/10/28
2021/10/28
40 バキスゼブリア筋注
アストラゼネカ
不明
1回目
アルコール摂取;
心肺停止(心肺停止)
2021/10/28
後遺症あり
タバコ使用者
TTS(血小板減少症を伴う血栓症)
2021/12/07
後遺症あり
血小板減少症を伴う血栓症
α
1
TTP、ITP等の血液疾患を除外出来てい
ないことから典型的なTTSの経過である
と判断することは容易ではないですが、
明らかな基礎疾患に伴わない急性上腸間
膜動脈閉塞症の発症、心肺停止後ではあ
るもののDダイマーが高値を示したこ
と、弱いながらも抗PF4抗体検査が陽性
を示したことから、バキスゼブリア接種
後によりTTSを発症した可能性があると
考えます。
※予防接種後副反応疑い報告書の別紙様式1の報告基準に記載のある症状(「その他の反応」は除く。)について、報告状況をもとに集計を行った。アナフィラキシーは、接種開始日(コミナティ筋注:令和3年2月17日、スパイクバックス筋注:令和3年5月22日、バキスゼブリア筋注:令和3年8月3日、コミナティ筋注5〜11歳用:令和4年2月21
日、ヌバキソビッド筋注:令和4年5月25日)以降の累計報告件数。TTSは、いずれのワクチンも令和3年8月3日以降に第一報の報告がなされたものの累計件数。心筋炎及び心膜炎は、いずれのワクチンも令和3年12月6日以降に第一報の報告がなされたものの累計件数。
※集計対象のMedDRA PT(ver.25.0)は以下のとおり。
アナフィラキシー:アナフィラキシーショック、アナフィラキシー様ショック、アナフィラキシー反応、アナフィラキシー様反応
心筋炎:免疫性心筋炎、好酸球性心筋炎、巨細胞性心筋炎、心筋炎、自己免疫性心筋炎、心筋心膜炎
心膜炎:心膜炎、胸膜心膜炎、自己免疫性心膜炎
TTSは、MedDRA (ver.25.0)にて、TTS関連事象を集計。
8
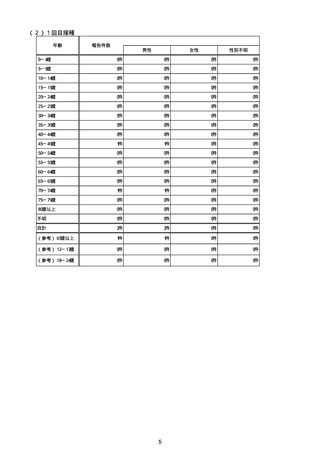
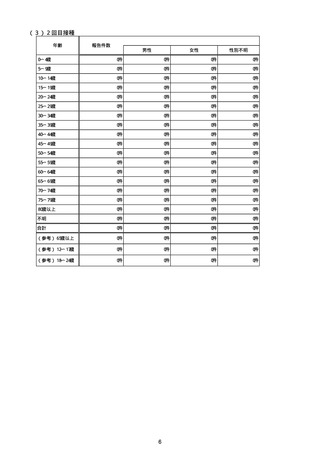
新型コロナワクチン接種後の血小板減少症を伴う血栓症疑いとして製造販売業者から報告された事例の一覧
(バキスゼブリア筋注、アストラゼネカ株式会社)
(令和3年8月3日から令和4年7月10日までの報告分)
※評価記号
α:「ワクチンと症状名との因果関係が否定できないもの」
原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、ワクチン接種が、事象発現の原因となったことが否定できない症例
β:「ワクチンと症状名との因果関係が認められないもの」
原疾患との関係、薬理学的な観点や時間的な経過などの要素を勘案し、医学・薬学的観点から総合的に判断し、ワクチン接種が、事象発現の原因となったとは認められない症例
γ:「情報不足等によりワクチンと症状名との因果関係が評価できないもの」
情報が十分でない、使用目的又は方法が適正でない等のためワクチン接種と事象発現との因果関係の評価ができない症例
注:「No」は、全新型コロナワクチンに係る副反応疑い報告(製造販売業者からの報告)の通番。
$
No
年齢
性別
接種日
発生日
$
接種から
発生までの
日数
ワクチン名
2022年7月10日現在
製造販売業者
ロット番号 接種回数
基礎疾患等
症状名(PT名)
転帰日
転帰内容
専門家の
因果関係評価
専門家の評価PT
専門家の
ブライトン分類レベ
ル
専門家の意見
備考
血小板減少を認めます。血液疾患の既往
を判断するために接種前の血小板の値が
欲しいところですが、
最終的に回復した値を参考に接種後に新
たに発生した血小板減少であることが推
測可能であると考えます。
造影CTによる画像所見において血栓症
(静脈洞、門脈内)が確認されていま
す。
23302 48歳 男性
2021/09/03
2021/09/04
2021/09/18
1 バキスゼブリア筋注
アストラゼネカ
K004C
1回目
タバコ使用者;
TTS(血小板減少症を伴う血栓症)
2021/10/01
肥満
末梢血管塞栓症(末梢血管塞栓症)
2021
後遺症あり
回復
血小板減少症を伴う血栓症
α
1
検査値異常(Dダイマーの著増)を認め
ます。
上記に加え、抗PF4抗体(ELISA法)が
陽性であることが確認され、
TMA(TTP, HUS)、DICを除外するため
の検査所見が得られてはいないものの、
臨床上バキスゼブリア投与による既知の
副反応であるTTSを発症したと判断する
ことが可能です。
以上より、本症例の因果関係を「因果関
係は否定できない」と評価します。
新たな血小板減少の発症及び血栓症/血
栓塞栓症の存在(造影CTによる画像所見
において、血栓症(上腸間膜動脈閉塞症
等)あり)がいずれも確認されていま
す。
ワクチン接種後から28日以上が経過して
いること、その他の血小板減少をきたす
23313 70歳 男性
2021/09/18
2021/10/28
2021/10/28
40 バキスゼブリア筋注
アストラゼネカ
不明
1回目
アルコール摂取;
心肺停止(心肺停止)
2021/10/28
後遺症あり
タバコ使用者
TTS(血小板減少症を伴う血栓症)
2021/12/07
後遺症あり
血小板減少症を伴う血栓症
α
1
TTP、ITP等の血液疾患を除外出来てい
ないことから典型的なTTSの経過である
と判断することは容易ではないですが、
明らかな基礎疾患に伴わない急性上腸間
膜動脈閉塞症の発症、心肺停止後ではあ
るもののDダイマーが高値を示したこ
と、弱いながらも抗PF4抗体検査が陽性
を示したことから、バキスゼブリア接種
後によりTTSを発症した可能性があると
考えます。
※予防接種後副反応疑い報告書の別紙様式1の報告基準に記載のある症状(「その他の反応」は除く。)について、報告状況をもとに集計を行った。アナフィラキシーは、接種開始日(コミナティ筋注:令和3年2月17日、スパイクバックス筋注:令和3年5月22日、バキスゼブリア筋注:令和3年8月3日、コミナティ筋注5〜11歳用:令和4年2月21
日、ヌバキソビッド筋注:令和4年5月25日)以降の累計報告件数。TTSは、いずれのワクチンも令和3年8月3日以降に第一報の報告がなされたものの累計件数。心筋炎及び心膜炎は、いずれのワクチンも令和3年12月6日以降に第一報の報告がなされたものの累計件数。
※集計対象のMedDRA PT(ver.25.0)は以下のとおり。
アナフィラキシー:アナフィラキシーショック、アナフィラキシー様ショック、アナフィラキシー反応、アナフィラキシー様反応
心筋炎:免疫性心筋炎、好酸球性心筋炎、巨細胞性心筋炎、心筋炎、自己免疫性心筋炎、心筋心膜炎
心膜炎:心膜炎、胸膜心膜炎、自己免疫性心膜炎
TTSは、MedDRA (ver.25.0)にて、TTS関連事象を集計。
8