よむ、つかう、まなぶ。
資料1-1-1 予防接種法に基づく医療機関からの副反応疑い報告状況について (67 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00046.html |
| 出典情報 | 第82回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第8回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(8/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
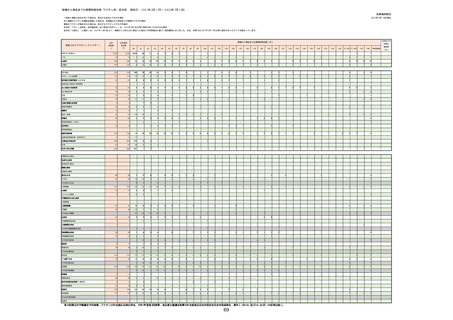
2.医療機関からの副反応疑い報告について(図表)
○コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
・コミナティ筋注(ファイザー)
・コミナティ筋注5〜11歳用(ファイザー)
・スパイクバックス筋注(モデルナ・ジャパン)
〇コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えサルアデノウイルスベクター)
・バキスゼブリア筋注(アストラゼネカ)
○組み換えコロナウイルス(SARS-CoV-2)ワクチン
・ヌバキソビッド筋注(武田薬品工業)
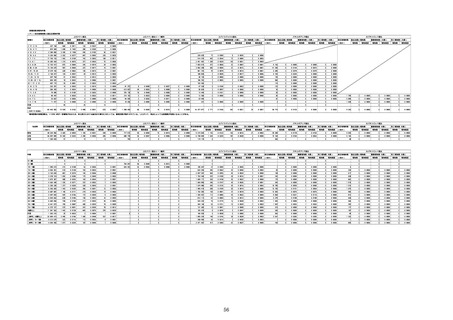
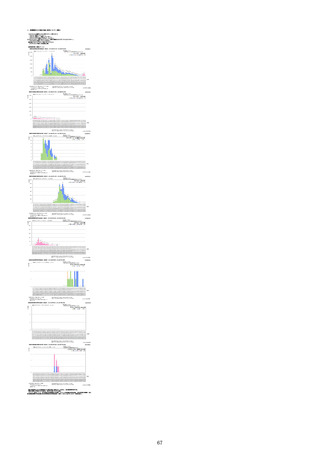
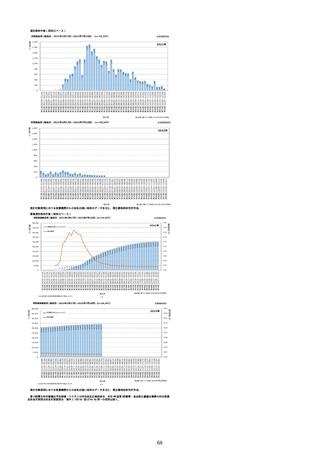
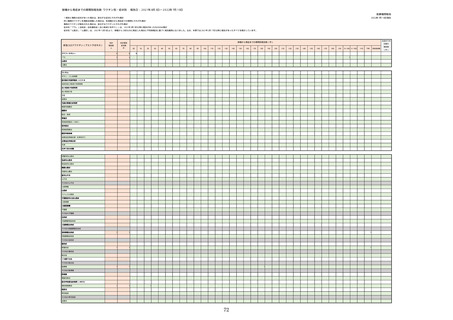
①週別報告件数(接種日ベース)
※集計対象期間における医療機関からの副反応疑い報告のデータを元に、国立感染症研究所作成。
※複数の接種日が報告された場合は、該当する週にそれぞれ集計。
※コミナティ筋注について、第81回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第6回薬事・食品
衛生審議会薬事分科会医薬品安全対策部会安全対策調査会 資料2-27のNo.5及びNo.6と同一の症例は除く。
67
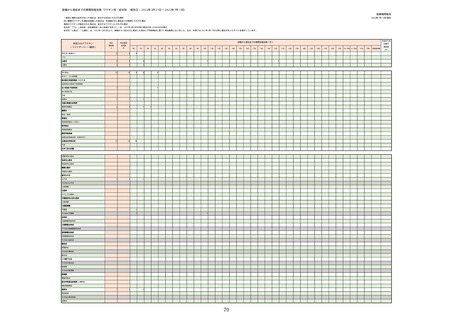
○コロナウイルス修飾ウリジンRNAワクチン(SARS-CoV-2)
・コミナティ筋注(ファイザー)
・コミナティ筋注5〜11歳用(ファイザー)
・スパイクバックス筋注(モデルナ・ジャパン)
〇コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えサルアデノウイルスベクター)
・バキスゼブリア筋注(アストラゼネカ)
○組み換えコロナウイルス(SARS-CoV-2)ワクチン
・ヌバキソビッド筋注(武田薬品工業)
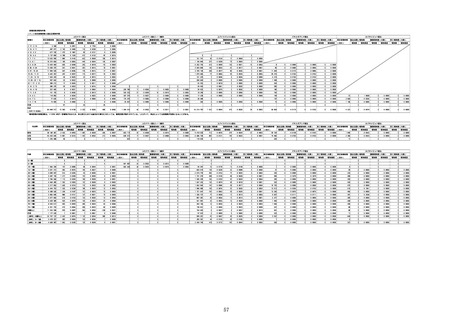
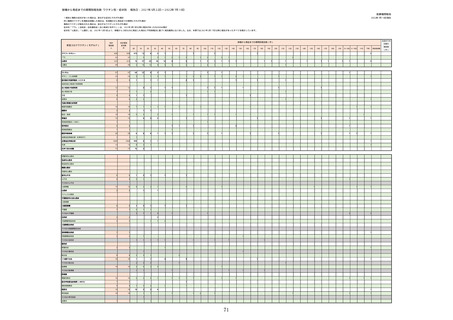
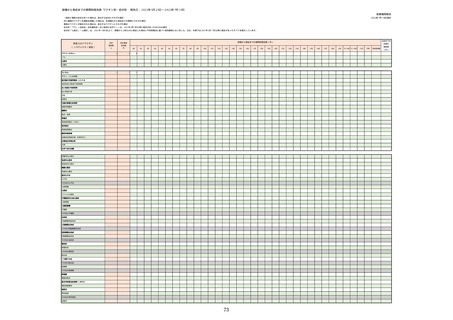
①週別報告件数(接種日ベース)
※集計対象期間における医療機関からの副反応疑い報告のデータを元に、国立感染症研究所作成。
※複数の接種日が報告された場合は、該当する週にそれぞれ集計。
※コミナティ筋注について、第81回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第6回薬事・食品
衛生審議会薬事分科会医薬品安全対策部会安全対策調査会 資料2-27のNo.5及びNo.6と同一の症例は除く。
67