よむ、つかう、まなぶ。
参考資料1 検討会の進め方(流れ図) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27272.html |
| 出典情報 | 医療ニーズの高い医療機器等の早期導入に関する検討会(第33回 8/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
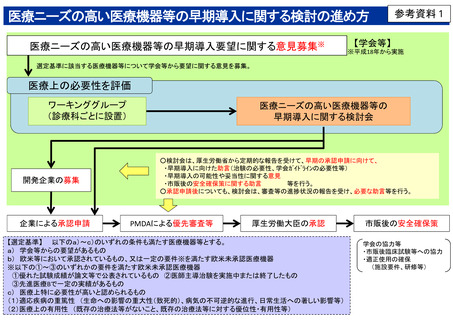
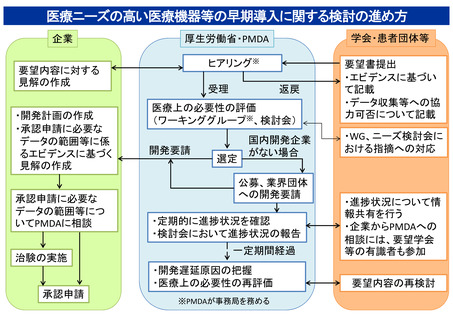
医療ニーズの高い医療機器等の早期導入に関する検討の進め方
医療ニーズの高い医療機器等の早期導入要望に関する意見募集※
1
参考資料3
【学会等】
※平成18年から実施
選定基準に該当する医療機器等について学会等から要望に関する意見を募集。
医療上の必要性を評価
ワーキンググループ
(診療科ごとに設置)
開発企業の募集
企業による承認申請
医療ニーズの高い医療機器等の
早期導入に関する検討会
○検討会は、厚生労働省から定期的な報告を受けて、早期の承認申請に向けて、
・早期導入に向けた助言(治験の必要性、学会ガイドラインの必要性等)
・早期導入の可能性や妥当性に関する意見
・市販後の安全確保策に関する助言
等を行う。
○承認申請後についても、検討会は、審査等の進捗状況の報告を受け、必要な助言等を行う。
PMDAによる優先審査等
厚生労働大臣の承認
【選定基準】 以下のa)~c)のいずれの条件も満たす医療機器等とする。
a) 学会等からの要望があるもの
b) 欧米等において承認されているもの、又は一定の要件※を満たす欧米未承認医療機器
※以下の①~③のいずれかの要件を満たす欧米未承認医療機器
①優れた試験成績が論文等で公表されているもの ②医師主導治験を実施中または終了したもの
③先進医療Bで一定の実績があるもの
c) 医療上特に必要性が高いと認められるもの
(1)適応疾病の重篤性 (生命への影響の重大性(致死的)、病気の不可逆的な進行、日常生活への著しい影響等)
(2)医療上の有用性 (既存の治療法等がないこと、既存の治療法等に対する優位性・有用性等)
市販後の安全確保策
学会の協力等
・市販後臨床試験等への協力
・適正使用の確保
(施設要件、研修等)
医療ニーズの高い医療機器等の早期導入要望に関する意見募集※
1
参考資料3
【学会等】
※平成18年から実施
選定基準に該当する医療機器等について学会等から要望に関する意見を募集。
医療上の必要性を評価
ワーキンググループ
(診療科ごとに設置)
開発企業の募集
企業による承認申請
医療ニーズの高い医療機器等の
早期導入に関する検討会
○検討会は、厚生労働省から定期的な報告を受けて、早期の承認申請に向けて、
・早期導入に向けた助言(治験の必要性、学会ガイドラインの必要性等)
・早期導入の可能性や妥当性に関する意見
・市販後の安全確保策に関する助言
等を行う。
○承認申請後についても、検討会は、審査等の進捗状況の報告を受け、必要な助言等を行う。
PMDAによる優先審査等
厚生労働大臣の承認
【選定基準】 以下のa)~c)のいずれの条件も満たす医療機器等とする。
a) 学会等からの要望があるもの
b) 欧米等において承認されているもの、又は一定の要件※を満たす欧米未承認医療機器
※以下の①~③のいずれかの要件を満たす欧米未承認医療機器
①優れた試験成績が論文等で公表されているもの ②医師主導治験を実施中または終了したもの
③先進医療Bで一定の実績があるもの
c) 医療上特に必要性が高いと認められるもの
(1)適応疾病の重篤性 (生命への影響の重大性(致死的)、病気の不可逆的な進行、日常生活への著しい影響等)
(2)医療上の有用性 (既存の治療法等がないこと、既存の治療法等に対する優位性・有用性等)
市販後の安全確保策
学会の協力等
・市販後臨床試験等への協力
・適正使用の確保
(施設要件、研修等)