よむ、つかう、まなぶ。
○新規技術(8月受理分)の先進医療A又は先進医療Bへの振り分けについて(案)別紙2 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00049.html |
| 出典情報 | 先進医療会議(第113回 8/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
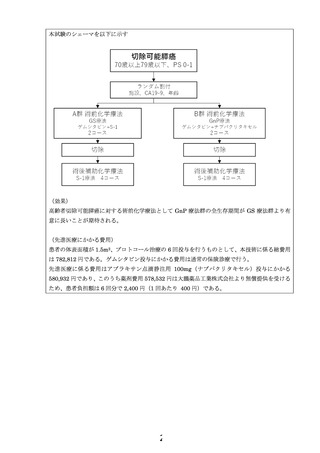
・登録後 14 日以内に治療を開始する。
・ナブパクリタキセル(品目名:アブラキサン)は、ゲムシタビンと併用して行う(ゲ
ムシタビン、ナブパクリタキセル併用療法(GnP 療法))。
・GnP 療法は、4 週を 1 コースとして、ゲムシタビン 1,000 mg/m2(day 1、8、15 30
分かけて経静脈投与)+ナブパクリタキセル 125 mg/m2(day 1、8、15 30 分かけて
経静脈投与)を行う。
・各投与前に、担当医が患者を診察し、身体所見、PS、血液検査から、有害事象発生
の有無を診療録に記載し、投与可能か判断をする。担当医の指示のもと、担当看護師
が投与する。
・GnP 療法を 2 コース実施し、治療終了後 3 週以降 8 週以内に外科切除を実施する。
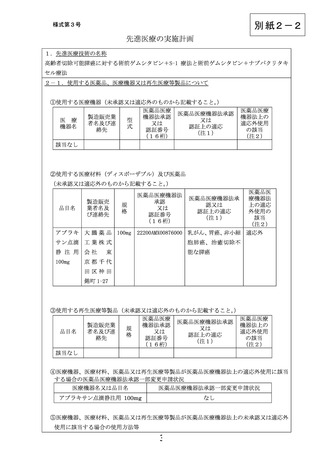
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された適応
の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
米国では、ゲムシタビン、パクリタキセル(アルブミン懸濁型)は治癒切除不能な膵癌を対
象に薬事承認されているが、切除可能膵癌に対しては術前投与・術後投与共に薬事承認されて
いない。National Comprehensive Cancer Network(NCCN)の膵癌の治療ガイドラインでは、
切除可能膵癌に対する術前化学療法の確立したエビデンスはまだ存在しないと考えられてお
り、画像所見、CA19-9 が非常に高値であること、大きな原発性腫瘍、大きな局所リンパ節、
高度の体重減少、高度の疼痛などの所見を有する高リスク患者の場合、術前化学療法を考慮す
るとしている。術前化学療法のレジメンに関しては、特定のレジメンを推奨するにはエビデン
スが少なく、特に規定されていないが、望ましいレジメンとして、mFOLFIRINOX 療法と GnP 療
法が示されている。
欧州での薬事承認の状況
欧州では、ゲムシタビン、パクリタキセル(アルブミン懸濁型)は治癒切除不能な膵癌に対して
薬事承認されているが、切除可能膵癌に対しては術前投与、術後投与共に薬事承認されていな
い。
4
・ナブパクリタキセル(品目名:アブラキサン)は、ゲムシタビンと併用して行う(ゲ
ムシタビン、ナブパクリタキセル併用療法(GnP 療法))。
・GnP 療法は、4 週を 1 コースとして、ゲムシタビン 1,000 mg/m2(day 1、8、15 30
分かけて経静脈投与)+ナブパクリタキセル 125 mg/m2(day 1、8、15 30 分かけて
経静脈投与)を行う。
・各投与前に、担当医が患者を診察し、身体所見、PS、血液検査から、有害事象発生
の有無を診療録に記載し、投与可能か判断をする。担当医の指示のもと、担当看護師
が投与する。
・GnP 療法を 2 コース実施し、治療終了後 3 週以降 8 週以内に外科切除を実施する。
⑥未承認又は適応外の場合は、□にレと記載する。
☑
当該医薬品・医療機器・再生医療等製品について、薬事承認の申請時及び
取得時において、申請企業から情報提供がなされることとなっている。
注1)医薬品医療機器法承認又は認証上の使用目的、効能及び効果を記入すること。
注2)医薬品医療機器法において適応外使用に該当する場合は「適応外」
、医薬品医療機器法で承認された適応
の範囲内の使用の場合は「適応内」と記載すること。
2-2.海外での承認に関する情報
米国での薬事承認の状況
米国では、ゲムシタビン、パクリタキセル(アルブミン懸濁型)は治癒切除不能な膵癌を対
象に薬事承認されているが、切除可能膵癌に対しては術前投与・術後投与共に薬事承認されて
いない。National Comprehensive Cancer Network(NCCN)の膵癌の治療ガイドラインでは、
切除可能膵癌に対する術前化学療法の確立したエビデンスはまだ存在しないと考えられてお
り、画像所見、CA19-9 が非常に高値であること、大きな原発性腫瘍、大きな局所リンパ節、
高度の体重減少、高度の疼痛などの所見を有する高リスク患者の場合、術前化学療法を考慮す
るとしている。術前化学療法のレジメンに関しては、特定のレジメンを推奨するにはエビデン
スが少なく、特に規定されていないが、望ましいレジメンとして、mFOLFIRINOX 療法と GnP 療
法が示されている。
欧州での薬事承認の状況
欧州では、ゲムシタビン、パクリタキセル(アルブミン懸濁型)は治癒切除不能な膵癌に対して
薬事承認されているが、切除可能膵癌に対しては術前投与、術後投与共に薬事承認されていな
い。
4