よむ、つかう、まなぶ。
令和4年度保険医療材料制度の見直しについて-4-1参考1 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00134.html |
| 出典情報 | 中央社会保険医療協議会 総会(第511回 1/19)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
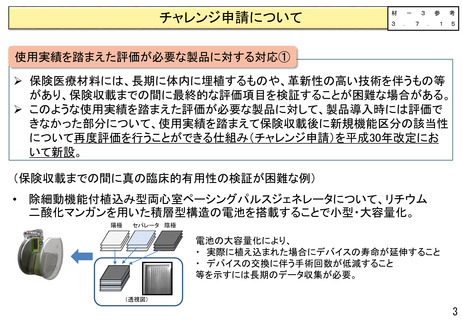
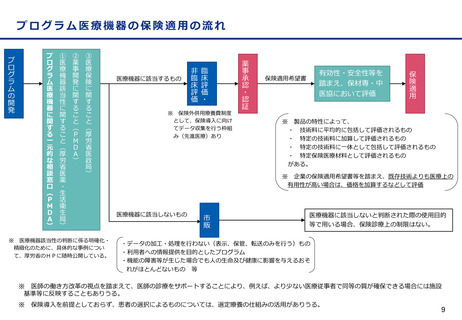
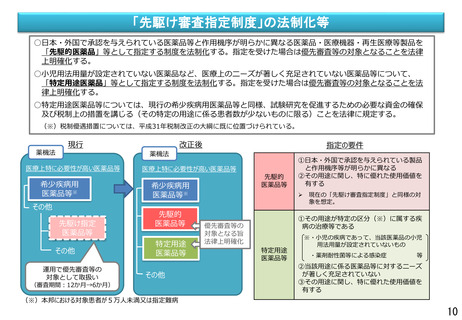
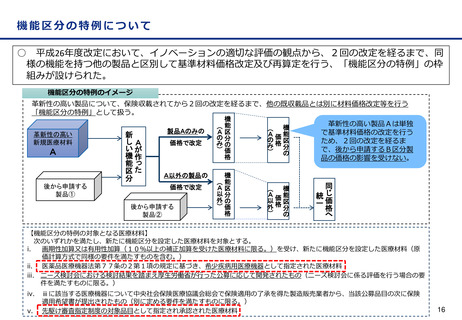
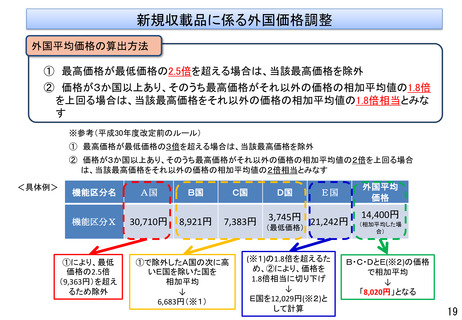
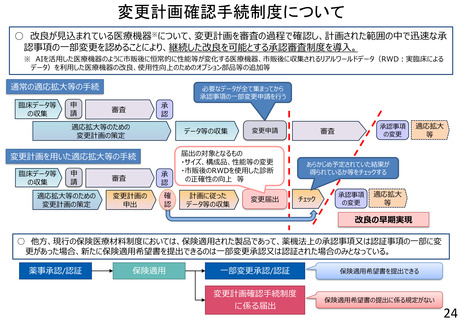
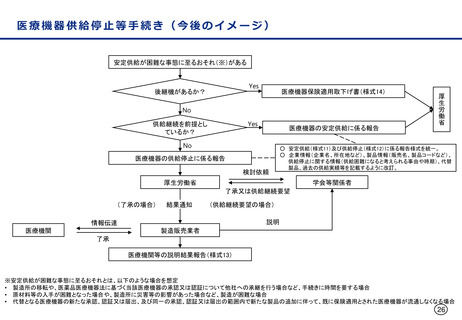
変更計画確認手続制度について
○ 改良が見込まれている医療機器※について、変更計画を審査の過程で確認し、計画された範囲の中で迅速な承
認事項の一部変更を認めることにより、継続した改良を可能とする承認審査制度を導入。
※ AIを活用した医療機器のように市販後に恒常的に性能等が変化する医療機器、市販後に収集されるリアルワールドデータ(RWD:実臨床による
データ)を利用した医療機器の改良、使用性向上のためのオプション部品等の追加等
通常の適応拡大等の手続
臨床データ等
の収集
申
請
必要なデータが全て集まってから
承認事項の一部変更申請を行う
承
認
審査
適応拡大等のための
変更計画の策定
データ等の収集
変更計画を用いた適応拡大等の手続
臨床データ等
の収集
申
請
適応拡大等のための
変更計画の策定
承
認
審査
変更計画の
申出
確
認
変更申請
届出の対象となるもの
・サイズ、構成品、性能等の変更
・市販後のRWDを使用した診断
の正確性の向上 等
計画に従った
データ等の収集
変更届出
承認事項
の変更
審査
適応拡大
等
あらかじめ予定されていた結果が
得られているか等をチェックする
チェック
承認事項
の変更
適応拡大
等
改良の早期実現
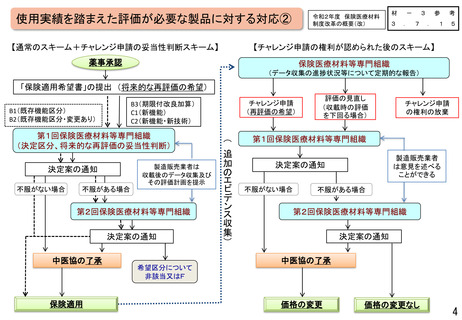
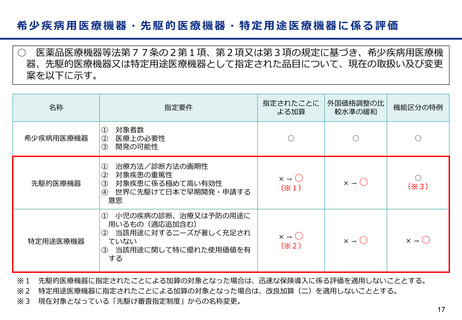
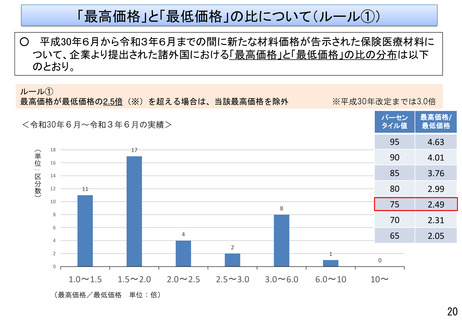
○ 他方、現行の保険医療材料制度においては、保険適用された製品であって、薬機法上の承認事項又は認証事項の一部に変
更があった場合、新たに保険適用希望書を提出できるのは一部変更承認又は認証された場合のみとなっている。
薬事承認/認証
保険適用
一部変更承認/認証
保険適用希望書を提出できる
変更計画確認手続制度
に係る届出
保険適用希望書の提出に係る規定がない
24
○ 改良が見込まれている医療機器※について、変更計画を審査の過程で確認し、計画された範囲の中で迅速な承
認事項の一部変更を認めることにより、継続した改良を可能とする承認審査制度を導入。
※ AIを活用した医療機器のように市販後に恒常的に性能等が変化する医療機器、市販後に収集されるリアルワールドデータ(RWD:実臨床による
データ)を利用した医療機器の改良、使用性向上のためのオプション部品等の追加等
通常の適応拡大等の手続
臨床データ等
の収集
申
請
必要なデータが全て集まってから
承認事項の一部変更申請を行う
承
認
審査
適応拡大等のための
変更計画の策定
データ等の収集
変更計画を用いた適応拡大等の手続
臨床データ等
の収集
申
請
適応拡大等のための
変更計画の策定
承
認
審査
変更計画の
申出
確
認
変更申請
届出の対象となるもの
・サイズ、構成品、性能等の変更
・市販後のRWDを使用した診断
の正確性の向上 等
計画に従った
データ等の収集
変更届出
承認事項
の変更
審査
適応拡大
等
あらかじめ予定されていた結果が
得られているか等をチェックする
チェック
承認事項
の変更
適応拡大
等
改良の早期実現
○ 他方、現行の保険医療材料制度においては、保険適用された製品であって、薬機法上の承認事項又は認証事項の一部に変
更があった場合、新たに保険適用希望書を提出できるのは一部変更承認又は認証された場合のみとなっている。
薬事承認/認証
保険適用
一部変更承認/認証
保険適用希望書を提出できる
変更計画確認手続制度
に係る届出
保険適用希望書の提出に係る規定がない
24