よむ、つかう、まなぶ。
【参考資料3】医薬品等行政評価・監視委員会の概要等 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26381.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第8回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
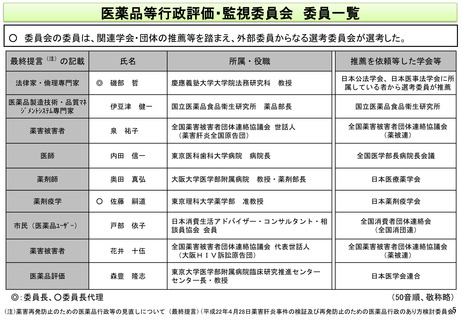
医薬品等行政評価・監視委員会で主に扱う事項
○ 評価・監視委員会では主に、(1)医薬・生活衛生局からの定期報告、(2)薬事制度の確認・評価、
(3)委員の求めに応じた個別事項への対応、を扱う。
項目
具体的な内容の例
•
安全性確保のプロセスが適正に行われているのかを確認するための情報
①製造販売承認された新医薬品の情報(該当品の一覧表)
(報告対象)先駆け審査や条件付き早期承認制度の対象品目、海外で承認されていな
い医薬品
(1)医薬・生活衛生局か
らの定期報告
②市販後の安全性情報の収集・評価の状況
(報告対象)緊急性安全性情報、添付文書の改訂内容等
③海外における安全対策の措置状況(国内での対応状況を含む)
(報告対象)安全性の懸念による販売中止、回収、医療従事者向けの情報提供等
(2)薬事制度の確認・評
価
(3)委員の求めに応じた
個別事項への対応
(4)その他
•
関係部局等のヒアリング
(例)市販後安全対策、承認審査、広告規制、薬害肝炎検証・検討委員会の最終提言
への対応状況 など
•
必要に応じて個別議題を設定
(例)新型コロナウイルスの治療薬やワクチン、後発医薬品の製造管理及び品質管理
•
•
海外調査(欧米の薬事制度、個別医薬品の承認状況等)
評価・監視委員会の運営規程
(例)利益相反、審議参加規定等
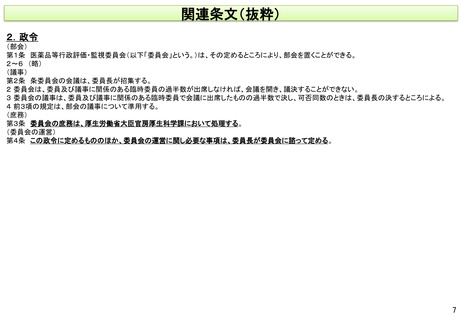
(注) 個別の医薬品等の有効性及び安全性に関する最終的な評価は、従来どおり、薬事・食品衛生審議会が行う。
4
○ 評価・監視委員会では主に、(1)医薬・生活衛生局からの定期報告、(2)薬事制度の確認・評価、
(3)委員の求めに応じた個別事項への対応、を扱う。
項目
具体的な内容の例
•
安全性確保のプロセスが適正に行われているのかを確認するための情報
①製造販売承認された新医薬品の情報(該当品の一覧表)
(報告対象)先駆け審査や条件付き早期承認制度の対象品目、海外で承認されていな
い医薬品
(1)医薬・生活衛生局か
らの定期報告
②市販後の安全性情報の収集・評価の状況
(報告対象)緊急性安全性情報、添付文書の改訂内容等
③海外における安全対策の措置状況(国内での対応状況を含む)
(報告対象)安全性の懸念による販売中止、回収、医療従事者向けの情報提供等
(2)薬事制度の確認・評
価
(3)委員の求めに応じた
個別事項への対応
(4)その他
•
関係部局等のヒアリング
(例)市販後安全対策、承認審査、広告規制、薬害肝炎検証・検討委員会の最終提言
への対応状況 など
•
必要に応じて個別議題を設定
(例)新型コロナウイルスの治療薬やワクチン、後発医薬品の製造管理及び品質管理
•
•
海外調査(欧米の薬事制度、個別医薬品の承認状況等)
評価・監視委員会の運営規程
(例)利益相反、審議参加規定等
(注) 個別の医薬品等の有効性及び安全性に関する最終的な評価は、従来どおり、薬事・食品衛生審議会が行う。
4