よむ、つかう、まなぶ。
参考資料12 積極的勧奨再開後のHPVワクチンの安全性評価スケジュールについて(令和4年1月21日合同部会資料2-30) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00043.html |
| 出典情報 | 第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第5回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(6/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
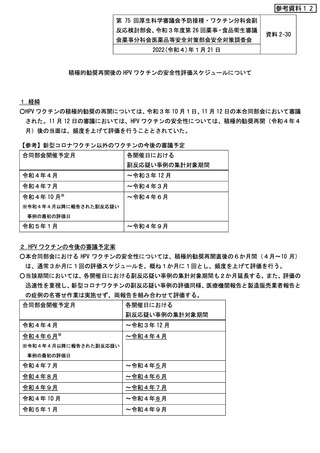
参考資料12
第 75 回厚生科学審議会予防接種・ワクチン分科会副
反応検討部会、令和3年度第 26 回薬事・食品衛生審議
会薬事分科会医薬品等安全対策部会安全対策調査会
資料 2-30
2022(令和4)年1月 21 日
積極的勧奨再開後の HPV ワクチンの安全性評価スケジュールについて
1.経緯
○HPV ワクチンの積極的勧奨の再開については、令和3年 10 月1日、11 月 12 日の本合同部会において審議
された。11 月 12 日の審議においては、HPV ワクチンの安全性については、積極的勧奨再開(令和4年4
月)後の当面は、頻度を上げて評価を行うこととされていた。
【参考】新型コロナワクチン以外のワクチンの今後の審議予定
合同部会開催予定月
各開催日における
副反応疑い事例の集計対象期間
令和4年4月
~令和3年 12 月
令和4年7月
~令和4年3月
令和4年 10 月※
~令和4年6月
※令和4年4月以降に報告された副反応疑い
事例の最初の評価日
令和5年1月
~令和4年9月
2.HPV ワクチンの今後の審議予定案
○本合同部会における HPV ワクチンの安全性については、積極的勧奨再開直後の6か月間(4月~10 月)
は、通常3か月に1回の評価スケジュールを、概ね1か月に1回とし、頻度を上げて評価を行う。
○当該期間においては、各開催日における副反応疑い事例の集計対象期間も2か月延長する。また、評価の
迅速性を重視し、新型コロナワクチンの副反応疑い事例の評価同様、医療機関報告と製造販売業者報告と
の症例の名寄せ作業は実施せず、両報告を組み合わせて評価する。
合同部会開催予定月
各開催日における
副反応疑い事例の集計対象期間
令和4年4月
~令和3年 12 月
令和4年6月※
~令和4年4月
※令和4年4月以降に報告された副反応疑い
事例の最初の評価日
令和4年7月
~令和4年5月
令和4年8月
~令和4年6月
令和4年9月
~令和4年7月
令和4年 10 月
~令和4年8月
令和5年1月
~令和4年9月
第 75 回厚生科学審議会予防接種・ワクチン分科会副
反応検討部会、令和3年度第 26 回薬事・食品衛生審議
会薬事分科会医薬品等安全対策部会安全対策調査会
資料 2-30
2022(令和4)年1月 21 日
積極的勧奨再開後の HPV ワクチンの安全性評価スケジュールについて
1.経緯
○HPV ワクチンの積極的勧奨の再開については、令和3年 10 月1日、11 月 12 日の本合同部会において審議
された。11 月 12 日の審議においては、HPV ワクチンの安全性については、積極的勧奨再開(令和4年4
月)後の当面は、頻度を上げて評価を行うこととされていた。
【参考】新型コロナワクチン以外のワクチンの今後の審議予定
合同部会開催予定月
各開催日における
副反応疑い事例の集計対象期間
令和4年4月
~令和3年 12 月
令和4年7月
~令和4年3月
令和4年 10 月※
~令和4年6月
※令和4年4月以降に報告された副反応疑い
事例の最初の評価日
令和5年1月
~令和4年9月
2.HPV ワクチンの今後の審議予定案
○本合同部会における HPV ワクチンの安全性については、積極的勧奨再開直後の6か月間(4月~10 月)
は、通常3か月に1回の評価スケジュールを、概ね1か月に1回とし、頻度を上げて評価を行う。
○当該期間においては、各開催日における副反応疑い事例の集計対象期間も2か月延長する。また、評価の
迅速性を重視し、新型コロナワクチンの副反応疑い事例の評価同様、医療機関報告と製造販売業者報告と
の症例の名寄せ作業は実施せず、両報告を組み合わせて評価する。
合同部会開催予定月
各開催日における
副反応疑い事例の集計対象期間
令和4年4月
~令和3年 12 月
令和4年6月※
~令和4年4月
※令和4年4月以降に報告された副反応疑い
事例の最初の評価日
令和4年7月
~令和4年5月
令和4年8月
~令和4年6月
令和4年9月
~令和4年7月
令和4年 10 月
~令和4年8月
令和5年1月
~令和4年9月