よむ、つかう、まなぶ。
資料 4-5 企業から提出された開発工程表の概要等(第Ⅲ回要望)[281KB] (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00042.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第68回 7/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
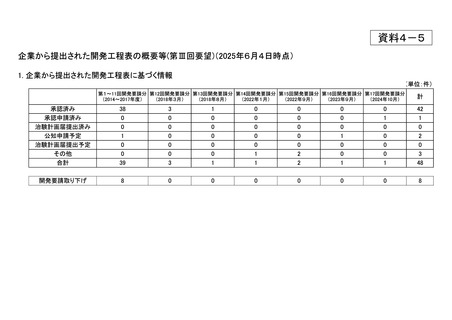
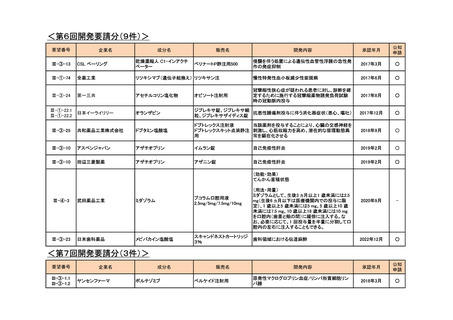
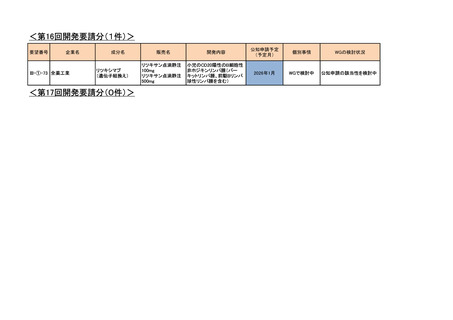
III-③-11
III-③-26
第一三共
インドシアニングリーン
ジアグノグリーン注射用
血管及び組織の血流評価
2018年7月
Ⅲ-①-80
あすか製薬
レボチロキシンナトリウム
チラーヂンS静注液200μg
粘液水腫性昏睡、重症甲状腺機能低下症
2020年1月
○
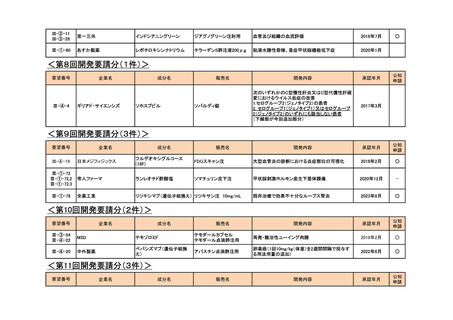
<第8回開発要請分(1件)>
要望番号
Ⅲ-④-4
企業名
ギリアド・サイエンシズ
成分名
ソホスブビル
販売名
ソバルディ錠
公知
申請
開発内容
承認年月
次のいずれかのC型慢性肝炎又はC型代償性肝硬
変におけるウイルス血症の改善
1.セログループ2(ジェノタイプ2)の患者
2. セログループ1(ジェノタイプ1)又はセログループ
2(ジェノタイプ2)のいずれにも該当しない患者
(下線部が今回追加部分)
2017年3月
開発内容
承認年月
公知
申請
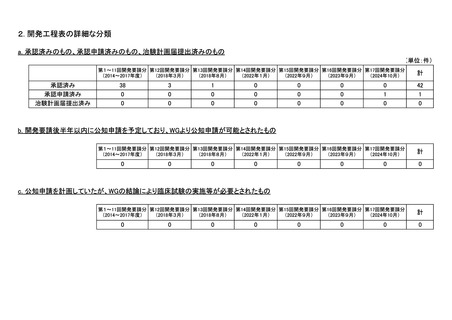
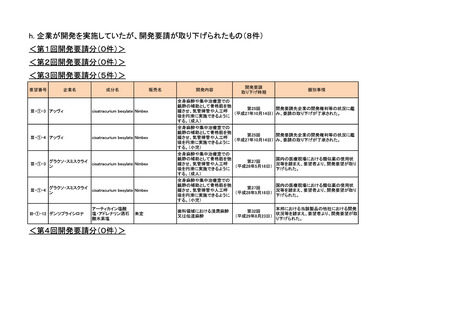
<第9回開発要請分(3件)>
要望番号
企業名
成分名
販売名
III-④-19
日本メジフィジックス
フルデオキシグルコース
(18F)
FDGスキャン注
大型血管炎の診断における炎症部位の可視化
2018年2月
○
Ⅲ-①-72
Ⅲ-①-72.2
Ⅲ-①-72.3
帝人ファーマ
ランレオチド酢酸塩
ソマチュリン皮下注
甲状腺刺激ホルモン産生下垂体腫瘍
2020年12月
-
Ⅲ-①-78
全薬工業
リツキシマブ(遺伝子組換え) リツキサン注 10mg/mL
既存治療で効果不十分なループス腎炎
2023年8月
○
開発内容
承認年月
公知
申請
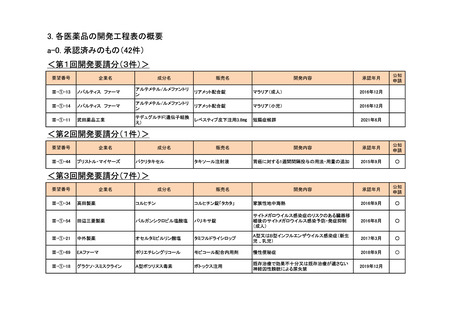
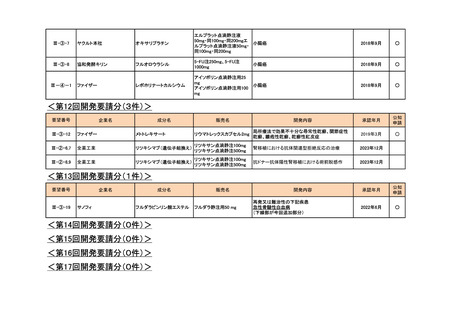
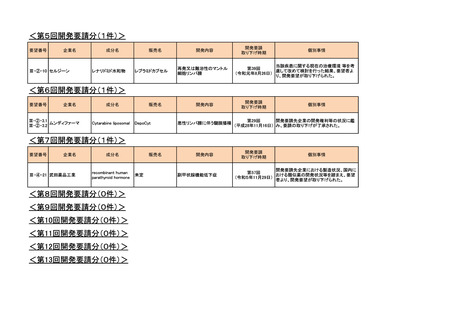
<第10回開発要請分(2件)>
要望番号
企業名
成分名
販売名
Ⅲ-③-54
Ⅲ-④-22
MSD
テモゾロミド
テモダールカプセル
テモダール点滴静注用
再発・難治性ユーイング肉腫
2019年2月
○
Ⅲ-④-20
中外製薬
ベバシズマブ(遺伝子組換
え)
アバスチン点滴静注用
卵巣癌(1回10mg/kg(体重)を2週間間隔で投与す
る用法用量の追加)
2022年6月
○
開発内容
承認年月
公知
申請
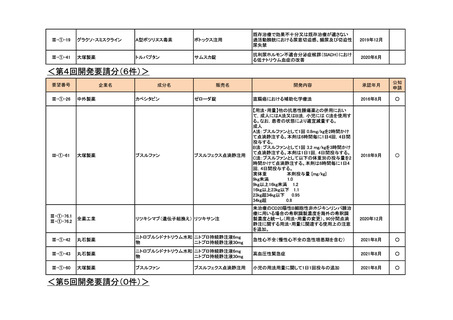
<第11回開発要請分(3件)>
要望番号
企業名
成分名
販売名
III-③-26
第一三共
インドシアニングリーン
ジアグノグリーン注射用
血管及び組織の血流評価
2018年7月
Ⅲ-①-80
あすか製薬
レボチロキシンナトリウム
チラーヂンS静注液200μg
粘液水腫性昏睡、重症甲状腺機能低下症
2020年1月
○
<第8回開発要請分(1件)>
要望番号
Ⅲ-④-4
企業名
ギリアド・サイエンシズ
成分名
ソホスブビル
販売名
ソバルディ錠
公知
申請
開発内容
承認年月
次のいずれかのC型慢性肝炎又はC型代償性肝硬
変におけるウイルス血症の改善
1.セログループ2(ジェノタイプ2)の患者
2. セログループ1(ジェノタイプ1)又はセログループ
2(ジェノタイプ2)のいずれにも該当しない患者
(下線部が今回追加部分)
2017年3月
開発内容
承認年月
公知
申請
<第9回開発要請分(3件)>
要望番号
企業名
成分名
販売名
III-④-19
日本メジフィジックス
フルデオキシグルコース
(18F)
FDGスキャン注
大型血管炎の診断における炎症部位の可視化
2018年2月
○
Ⅲ-①-72
Ⅲ-①-72.2
Ⅲ-①-72.3
帝人ファーマ
ランレオチド酢酸塩
ソマチュリン皮下注
甲状腺刺激ホルモン産生下垂体腫瘍
2020年12月
-
Ⅲ-①-78
全薬工業
リツキシマブ(遺伝子組換え) リツキサン注 10mg/mL
既存治療で効果不十分なループス腎炎
2023年8月
○
開発内容
承認年月
公知
申請
<第10回開発要請分(2件)>
要望番号
企業名
成分名
販売名
Ⅲ-③-54
Ⅲ-④-22
MSD
テモゾロミド
テモダールカプセル
テモダール点滴静注用
再発・難治性ユーイング肉腫
2019年2月
○
Ⅲ-④-20
中外製薬
ベバシズマブ(遺伝子組換
え)
アバスチン点滴静注用
卵巣癌(1回10mg/kg(体重)を2週間間隔で投与す
る用法用量の追加)
2022年6月
○
開発内容
承認年月
公知
申請
<第11回開発要請分(3件)>
要望番号
企業名
成分名
販売名