よむ、つかう、まなぶ。
総-2 再生医療等製品の医療保険上の取扱いについて[776KB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58800.html |
| 出典情報 | 中央社会保険医療協議会 総会(第609回 6/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
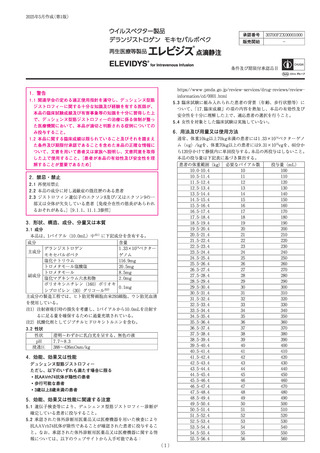
再生医療等製品の取扱いについて
類別
遺伝子治療用製品(ウイルスベクター製品)
一般的名称
デランジストロゲン モキセパルボベク
収載希望者
中外製薬(株)
販売名
エレビジス点滴静注
1 バイアル(10.0mL)中に、アデノ随伴ウイルス rh74 のカプシドタンパク
形状、成分、
分量等
質を有し、デランジストロゲン モキセパルボベク
マイクロジストロフィ
ンタンパク質を発現する遺伝子を搭載した非増殖性遺伝子組換えアデノ随
伴ウイルス 1.33×1014 ベクターゲノムを含有
承認区分
新再生医療等製品(希少疾病用再生医療等製品)
デュシェンヌ型筋ジストロフィー ただし、以下のいずれも満たす場合に限
効能、効果
又は性能
る
・抗 AAVrh74 抗体が陰性の患者
・歩行可能な患者
・3 歳以上 8 歳未満の患者
通常、体重 10 kg 以上 70 kg 未満の患者には 1.33×1014 ベクターゲノム(vg)
用法及び用量
又は使用方法
/kg を、体重 70 kg 以上の患者には 9.31×1015 vg を、60 分から 120 分かけ
て静脈内に単回投与する。本品の再投与はしないこと。本品の投与量は下記
表に基づき算出する。
(表略)
医療保険上の取扱い(案)
○
本品は重篤な疾患に用いられる再生医療等製品として5月 13 日に条件及び期限
付き承認されたが、6月 16 日に本品の開発会社が以下の新たな安全性情報に関す
る発表をした。
・歩行不能な患者で致死的な経過を辿った急性肝不全の報告。
・これにより国内で実施中の歩行不能な患者を対象とした臨床試験も投与を中断
すること。
・
(承認されている)歩行可能な患者における本品のベネフィット・リスクプロファ
イルに変更はないこと。
○
上記の情報についての評価は現時点で明らかでないことから、まずは、新たな安
全性情報に関して更なる情報を収集した上で、医療保険上の取扱いについて議論
することとしてはどうか。
2
類別
遺伝子治療用製品(ウイルスベクター製品)
一般的名称
デランジストロゲン モキセパルボベク
収載希望者
中外製薬(株)
販売名
エレビジス点滴静注
1 バイアル(10.0mL)中に、アデノ随伴ウイルス rh74 のカプシドタンパク
形状、成分、
分量等
質を有し、デランジストロゲン モキセパルボベク
マイクロジストロフィ
ンタンパク質を発現する遺伝子を搭載した非増殖性遺伝子組換えアデノ随
伴ウイルス 1.33×1014 ベクターゲノムを含有
承認区分
新再生医療等製品(希少疾病用再生医療等製品)
デュシェンヌ型筋ジストロフィー ただし、以下のいずれも満たす場合に限
効能、効果
又は性能
る
・抗 AAVrh74 抗体が陰性の患者
・歩行可能な患者
・3 歳以上 8 歳未満の患者
通常、体重 10 kg 以上 70 kg 未満の患者には 1.33×1014 ベクターゲノム(vg)
用法及び用量
又は使用方法
/kg を、体重 70 kg 以上の患者には 9.31×1015 vg を、60 分から 120 分かけ
て静脈内に単回投与する。本品の再投与はしないこと。本品の投与量は下記
表に基づき算出する。
(表略)
医療保険上の取扱い(案)
○
本品は重篤な疾患に用いられる再生医療等製品として5月 13 日に条件及び期限
付き承認されたが、6月 16 日に本品の開発会社が以下の新たな安全性情報に関す
る発表をした。
・歩行不能な患者で致死的な経過を辿った急性肝不全の報告。
・これにより国内で実施中の歩行不能な患者を対象とした臨床試験も投与を中断
すること。
・
(承認されている)歩行可能な患者における本品のベネフィット・リスクプロファ
イルに変更はないこと。
○
上記の情報についての評価は現時点で明らかでないことから、まずは、新たな安
全性情報に関して更なる情報を収集した上で、医療保険上の取扱いについて議論
することとしてはどうか。
2