よむ、つかう、まなぶ。
参考資料6 新型コロナワクチン「コスタイベ筋注用」(Meiji Seika ファルマ株式会社)添付文書[892KB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00138.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第106回 4/14)医薬品等安全対策部会安全対策調査会(令和7年度第1回 4/14)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
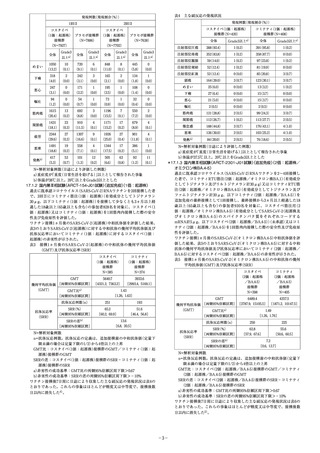
表4 主な副反応の発現状況
発現例数
(発現割合
(%)
)
1回目
発現例数
(発現割合
(%)
)
2回目
コスタイベ
(1価:起源株)
接種群
(N=420)
コスタイベ
コスタイベ
(1価:起源株) プラセボ接種群 (1価:起源株) プラセボ接種群
(N=7886)
(N=7638)
接種群
接種群
(N=7927)
(N=7702)
全体
Grade3
以上a)
全体
Grade3
以上a)
全体
Grade3
以上a)
全体
Grade3
以上a)
めまい
1050
10
720
6
848
8
445
0
(13.2) (0.1) (9.1) (0.1) (11.0) (0.1) (5.8) (0.0)
下痢
318
2
242
3
165
2
134
1
(4.0) (0.0) (3.1) (0.0) (2.1) (0.0) (1.8) (0.0)
悪心
コミナティ
(1価:起源株)
接種群
(N=408)
全体
Grade3以上a)
全体
注射部位圧痛
388
(92.4)
(0.2)
1
391
(95.8)
(0.2)
1
注射部位疼痛
352
(83.8)
(0.2)
1
358
(87.7)
(0.0)
0
Grade3以上a)
注射部位腫脹
59
(14.0)
(0.2)
1
97
(23.8)
(0.2)
1
注射部位硬結
52
(12.4)
(0.2)
1
81
(19.9)
(0.0)
0
注射部位紅斑
52
(12.4)
(0.0)
0
85
(20.8)
(0.7)
3
頭痛
164
(39.0)
(0.7)
3
123
(30.1)
(0.7)
3
247
0
171
1
195
1
108
0
(3.1) (0.0) (2.2) (0.0) (2.5) (0.0) (1.4) (0.0)
めまい
25
(6.0)
(0.0)
0
13
(3.2)
(0.2)
1
下痢
27
(6.4)
(0.0)
0
15
(3.7)
(0.0)
0
嘔吐
94
0
54
1
73
1
32
0
(1.2) (0.0) (0.7) (0.0) (0.9) (0.0) (0.4) (0.0)
悪心
21
(5.0)
(0.0)
0
15
(3.7)
(0.0)
0
筋肉痛
1615
13
692
3
1196
7
550
2
(20.4) (0.2) (8.8) (0.0) (15.5) (0.1) (7.2) (0.0)
1431
23
910
4
1171
17
679
4
(18.1) (0.3) (11.5) (0.1) (15.2) (0.2) (8.9) (0.1)
関節痛
112
(26.7)
(0.2)
1
113
(27.7)
(0.5)
2
関節痛
倦怠感
188
(44.8)
(0.7)
3
176
(43.1)
(1.0)
4
疲労
2344
27
1307
9
1926
27
901
4
(29.6) (0.3) (16.6) (0.1) (25.0) (0.4) (11.8) (0.1)
悪寒
126
(30.0)
(0.5)
2
103
(25.2)
(1.0)
4
発熱b)
84
(20.0)
(0.5)
2
76
(18.6)
(0.5)
2
悪寒
1491
19
558
4
1344
17
386
1
(18.8) (0.2) (7.1) (0.1) (17.5) (0.2) (5.1) (0.0)
発熱b)
417
53
101
12
505
63
92
11
(5.3) (0.7) (1.3) (0.2) (6.6) (0.8) (1.2) (0.1)
N=解析対象例数(日誌により評価した例数)
a)
重症度が「重度(日常生活を妨げる)
」
以上として報告された事象
b)
体温が38℃以上。39℃以上をGrade3以上とした
17.1.2 国内第Ⅲ相試験(ARCT-154-J01試験)
(追加免疫)
(1価:起源株)
過去に既承認コロナウイルス(SARS-CoV-2)RNAワクチンを3回接種した者
で、3回目にコミナティ筋注(1価:起源株)
(有効成分としてトジナメラン
30μg、以下コミナティ(1価:起源株))を接種して少なくとも3ヵ月以上経
過した18歳以上(65歳以上も含む)の参加者828名を対象に、コスタイベ(1
価:起源株)又はコミナティ(1価:起源株)を1回筋肉内接種した際の安全
性及び免疫原性を評価した。
ワクチン接種1ヵ月後のSARS-CoV-2(起源株)中和抗体価を評価した結果、
表3のとおりSARS-CoV-2(起源株)に対する中和抗体の幾何平均抗体価及び
抗体反応率においてコミナティ(1価:起源株)に対するコスタイベ(1価:
起源株)
の非劣性が示された。
表3 接種1ヵ月後のSARS-CoV-2( 起源株)の中和抗体の幾何平均抗体価
(GMT)
及び抗体反応率(SRR)
コスタイベ
(1価:起源株)
接種群
N=385
コミナティ
(1価:起源株)
接種群
N=374
嘔吐
(0.5)
2
(0.0)
0
(0.5)
2
(0.0)
0
筋肉痛
121
(28.8)
(0.5)
2
99
(24.3)
(0.7)
3
N=解析対象例数(日誌により評価した例数)
a)
重症度が「重度
(日常生活を妨げる)
」
以上として報告された事象
b)
体温が37.5℃以上。39℃以上をGrade3以上とした
*17.1.3 国内第Ⅲ相試験
(ARCT-2301-J01試験)
(追加免疫)
(2価:起源株/
オミクロン株BA.4-5)
過去に既承認コロナウイルス(SARS-CoV-2)RNAワクチンを2~4回接種し
た者で、コミナティRTU筋注(2価:起源株/オミクロン株BA.1)
(有効成分
としてトジナメラン及びリルトジナメラン計30μg)又はコミナティRTU筋
注(2価:起源株/オミクロン株BA.4-5)
(有効成分としてトジナメラン及び
ファムトジナメラン計30μg、以下コミナティ(2価:起源株/BA.4-5))を
追加免疫の最終接種として1回接種し、最終接種から3ヵ月以上経過した18
歳以上(65歳以上も含む)の参加者930名を対象に、コスタイベ筋注用(2
価:起源株/オミクロン株BA.4-5)
(有効成分としてSARS-CoV-2(起源株及
びオミクロン株BA.4-5)のスパイクタンパク質をそれぞれコードする
mRNA計5μg、以下コスタイベ(2価:起源株/BA.4-5))
(未承認)又はコミ
ナティ(2価:起源株/BA.4-5)を1回筋肉内接種した際の安全性及び免疫原
性を評価した。
ワクチン接種1ヵ月後のSARS-CoV-2(オミクロン株BA.4-5)中和抗体価を評
価した結果、表5のとおりSARS-CoV-2(オミクロン株BA.4-5)に対する中和
抗体の幾何平均抗体価及び抗体反応率においてコミナティ(2価:起源株/
BA.4-5)
に対するコスタイベ(2価:起源株/BA.4-5)
の非劣性が示された。
表5 接種1ヵ月後のSARS-CoV-2(オミクロン株BA.4-5)の中和抗体の幾何
平均抗体価(GMT)
及び抗体反応率(SRR)
GMT
5640.7
3933.6
幾何平均抗体価 [両側95%信頼区間] [4321.2, 7363.2] [2993.4, 5169.1]
(GMT)
1.43
GMT比a)
[1.26, 1.63]
[両側95%信頼区間]
抗体反応率
(SRR)
抗体反応例数
(n)
251
193
SRR
(%)
[両側95%信頼区間]
65.2
[60.2, 69.9]
51.6
[46.4, 56.8]
SRRの差b)
[両側95%信頼区間]
GMT
コスタイベ
(2価:起源株
/BA.4-5)
接種群
N=398
コミナティ
(2価:起源株
/BA.4-5)
接種群
N=405
6489.4
4357.5
幾何平均抗体価 [両側95%信頼区間] [2787.9, 15105.5] [1871.2, 10147.5]
(GMT)
1.49
GMT比a)
[1.26, 1.76]
[両側95%信頼区間]
13.6
[6.8, 20.5]
抗体反応率
(SRR)
N=解析対象例数
n=抗体反応例数。抗体反応の定義は、追加接種前の中和抗体価(定量下
限未満の場合は定量下限の1/2)
から4倍以上の上昇
GMT比:コスタイベ(1価:起源株)接種群のGMT/コミナティ(1価:起
源株)
接種群のGMT
SRRの差:コスタイベ(1価:起源株)接種群のSRR-コミナティ(1価:起
源株)
接種群のSRR
a)
非劣性の成功基準:GMT比の両側95%信頼区間下限>0.67
b)
非劣性の成功基準:SRRの差の両側95%信頼区間下限>-10%
ワクチン接種後7日間に日誌により収集した主な副反応の発現状況は表4の
とおりであった。これらの事象はほとんどが軽度又は中等度で、接種後数
抗体反応例数
(n)
250
225
SRR
(%)
[両側95%信頼区間]
62.8
[57.9, 67.6]
55.6
[50.6, 60.5]
SRRの差b)
[両側95%信頼区間]
7.2
[0.6, 13.7]
N=解析対象例数
n=抗体反応例数。抗体反応の定義は、追加接種前の中和抗体価(定量下
限未満の場合は定量下限の1/2)
から4倍以上の上昇
GMT比:コスタイベ(2価:起源株/BA.4-5)接種群のGMT/コミナティ
(2価:起源株/BA.4-5)
接種群のGMT
SRRの差:コスタイベ(2価:起源株/BA.4-5)接種群のSRR-コミナティ
(2価:起源株/BA.4-5)
接種群のSRR
a)
非劣性の成功基準:GMT比の両側95%信頼区間下限>0.67
b)
非劣性の成功基準:SRRの差の両側95%信頼区間下限>-10%
ワクチン接種後7日間に日誌により収集した主な副反応の発現状況は表6の
とおりであった。これらの事象はほとんどが軽度又は中等度で、接種後数
日以内に消失した4)。
日以内に消失した5)。
-3-
発現例数
(発現割合
(%)
)
1回目
発現例数
(発現割合
(%)
)
2回目
コスタイベ
(1価:起源株)
接種群
(N=420)
コスタイベ
コスタイベ
(1価:起源株) プラセボ接種群 (1価:起源株) プラセボ接種群
(N=7886)
(N=7638)
接種群
接種群
(N=7927)
(N=7702)
全体
Grade3
以上a)
全体
Grade3
以上a)
全体
Grade3
以上a)
全体
Grade3
以上a)
めまい
1050
10
720
6
848
8
445
0
(13.2) (0.1) (9.1) (0.1) (11.0) (0.1) (5.8) (0.0)
下痢
318
2
242
3
165
2
134
1
(4.0) (0.0) (3.1) (0.0) (2.1) (0.0) (1.8) (0.0)
悪心
コミナティ
(1価:起源株)
接種群
(N=408)
全体
Grade3以上a)
全体
注射部位圧痛
388
(92.4)
(0.2)
1
391
(95.8)
(0.2)
1
注射部位疼痛
352
(83.8)
(0.2)
1
358
(87.7)
(0.0)
0
Grade3以上a)
注射部位腫脹
59
(14.0)
(0.2)
1
97
(23.8)
(0.2)
1
注射部位硬結
52
(12.4)
(0.2)
1
81
(19.9)
(0.0)
0
注射部位紅斑
52
(12.4)
(0.0)
0
85
(20.8)
(0.7)
3
頭痛
164
(39.0)
(0.7)
3
123
(30.1)
(0.7)
3
247
0
171
1
195
1
108
0
(3.1) (0.0) (2.2) (0.0) (2.5) (0.0) (1.4) (0.0)
めまい
25
(6.0)
(0.0)
0
13
(3.2)
(0.2)
1
下痢
27
(6.4)
(0.0)
0
15
(3.7)
(0.0)
0
嘔吐
94
0
54
1
73
1
32
0
(1.2) (0.0) (0.7) (0.0) (0.9) (0.0) (0.4) (0.0)
悪心
21
(5.0)
(0.0)
0
15
(3.7)
(0.0)
0
筋肉痛
1615
13
692
3
1196
7
550
2
(20.4) (0.2) (8.8) (0.0) (15.5) (0.1) (7.2) (0.0)
1431
23
910
4
1171
17
679
4
(18.1) (0.3) (11.5) (0.1) (15.2) (0.2) (8.9) (0.1)
関節痛
112
(26.7)
(0.2)
1
113
(27.7)
(0.5)
2
関節痛
倦怠感
188
(44.8)
(0.7)
3
176
(43.1)
(1.0)
4
疲労
2344
27
1307
9
1926
27
901
4
(29.6) (0.3) (16.6) (0.1) (25.0) (0.4) (11.8) (0.1)
悪寒
126
(30.0)
(0.5)
2
103
(25.2)
(1.0)
4
発熱b)
84
(20.0)
(0.5)
2
76
(18.6)
(0.5)
2
悪寒
1491
19
558
4
1344
17
386
1
(18.8) (0.2) (7.1) (0.1) (17.5) (0.2) (5.1) (0.0)
発熱b)
417
53
101
12
505
63
92
11
(5.3) (0.7) (1.3) (0.2) (6.6) (0.8) (1.2) (0.1)
N=解析対象例数(日誌により評価した例数)
a)
重症度が「重度(日常生活を妨げる)
」
以上として報告された事象
b)
体温が38℃以上。39℃以上をGrade3以上とした
17.1.2 国内第Ⅲ相試験(ARCT-154-J01試験)
(追加免疫)
(1価:起源株)
過去に既承認コロナウイルス(SARS-CoV-2)RNAワクチンを3回接種した者
で、3回目にコミナティ筋注(1価:起源株)
(有効成分としてトジナメラン
30μg、以下コミナティ(1価:起源株))を接種して少なくとも3ヵ月以上経
過した18歳以上(65歳以上も含む)の参加者828名を対象に、コスタイベ(1
価:起源株)又はコミナティ(1価:起源株)を1回筋肉内接種した際の安全
性及び免疫原性を評価した。
ワクチン接種1ヵ月後のSARS-CoV-2(起源株)中和抗体価を評価した結果、
表3のとおりSARS-CoV-2(起源株)に対する中和抗体の幾何平均抗体価及び
抗体反応率においてコミナティ(1価:起源株)に対するコスタイベ(1価:
起源株)
の非劣性が示された。
表3 接種1ヵ月後のSARS-CoV-2( 起源株)の中和抗体の幾何平均抗体価
(GMT)
及び抗体反応率(SRR)
コスタイベ
(1価:起源株)
接種群
N=385
コミナティ
(1価:起源株)
接種群
N=374
嘔吐
(0.5)
2
(0.0)
0
(0.5)
2
(0.0)
0
筋肉痛
121
(28.8)
(0.5)
2
99
(24.3)
(0.7)
3
N=解析対象例数(日誌により評価した例数)
a)
重症度が「重度
(日常生活を妨げる)
」
以上として報告された事象
b)
体温が37.5℃以上。39℃以上をGrade3以上とした
*17.1.3 国内第Ⅲ相試験
(ARCT-2301-J01試験)
(追加免疫)
(2価:起源株/
オミクロン株BA.4-5)
過去に既承認コロナウイルス(SARS-CoV-2)RNAワクチンを2~4回接種し
た者で、コミナティRTU筋注(2価:起源株/オミクロン株BA.1)
(有効成分
としてトジナメラン及びリルトジナメラン計30μg)又はコミナティRTU筋
注(2価:起源株/オミクロン株BA.4-5)
(有効成分としてトジナメラン及び
ファムトジナメラン計30μg、以下コミナティ(2価:起源株/BA.4-5))を
追加免疫の最終接種として1回接種し、最終接種から3ヵ月以上経過した18
歳以上(65歳以上も含む)の参加者930名を対象に、コスタイベ筋注用(2
価:起源株/オミクロン株BA.4-5)
(有効成分としてSARS-CoV-2(起源株及
びオミクロン株BA.4-5)のスパイクタンパク質をそれぞれコードする
mRNA計5μg、以下コスタイベ(2価:起源株/BA.4-5))
(未承認)又はコミ
ナティ(2価:起源株/BA.4-5)を1回筋肉内接種した際の安全性及び免疫原
性を評価した。
ワクチン接種1ヵ月後のSARS-CoV-2(オミクロン株BA.4-5)中和抗体価を評
価した結果、表5のとおりSARS-CoV-2(オミクロン株BA.4-5)に対する中和
抗体の幾何平均抗体価及び抗体反応率においてコミナティ(2価:起源株/
BA.4-5)
に対するコスタイベ(2価:起源株/BA.4-5)
の非劣性が示された。
表5 接種1ヵ月後のSARS-CoV-2(オミクロン株BA.4-5)の中和抗体の幾何
平均抗体価(GMT)
及び抗体反応率(SRR)
GMT
5640.7
3933.6
幾何平均抗体価 [両側95%信頼区間] [4321.2, 7363.2] [2993.4, 5169.1]
(GMT)
1.43
GMT比a)
[1.26, 1.63]
[両側95%信頼区間]
抗体反応率
(SRR)
抗体反応例数
(n)
251
193
SRR
(%)
[両側95%信頼区間]
65.2
[60.2, 69.9]
51.6
[46.4, 56.8]
SRRの差b)
[両側95%信頼区間]
GMT
コスタイベ
(2価:起源株
/BA.4-5)
接種群
N=398
コミナティ
(2価:起源株
/BA.4-5)
接種群
N=405
6489.4
4357.5
幾何平均抗体価 [両側95%信頼区間] [2787.9, 15105.5] [1871.2, 10147.5]
(GMT)
1.49
GMT比a)
[1.26, 1.76]
[両側95%信頼区間]
13.6
[6.8, 20.5]
抗体反応率
(SRR)
N=解析対象例数
n=抗体反応例数。抗体反応の定義は、追加接種前の中和抗体価(定量下
限未満の場合は定量下限の1/2)
から4倍以上の上昇
GMT比:コスタイベ(1価:起源株)接種群のGMT/コミナティ(1価:起
源株)
接種群のGMT
SRRの差:コスタイベ(1価:起源株)接種群のSRR-コミナティ(1価:起
源株)
接種群のSRR
a)
非劣性の成功基準:GMT比の両側95%信頼区間下限>0.67
b)
非劣性の成功基準:SRRの差の両側95%信頼区間下限>-10%
ワクチン接種後7日間に日誌により収集した主な副反応の発現状況は表4の
とおりであった。これらの事象はほとんどが軽度又は中等度で、接種後数
抗体反応例数
(n)
250
225
SRR
(%)
[両側95%信頼区間]
62.8
[57.9, 67.6]
55.6
[50.6, 60.5]
SRRの差b)
[両側95%信頼区間]
7.2
[0.6, 13.7]
N=解析対象例数
n=抗体反応例数。抗体反応の定義は、追加接種前の中和抗体価(定量下
限未満の場合は定量下限の1/2)
から4倍以上の上昇
GMT比:コスタイベ(2価:起源株/BA.4-5)接種群のGMT/コミナティ
(2価:起源株/BA.4-5)
接種群のGMT
SRRの差:コスタイベ(2価:起源株/BA.4-5)接種群のSRR-コミナティ
(2価:起源株/BA.4-5)
接種群のSRR
a)
非劣性の成功基準:GMT比の両側95%信頼区間下限>0.67
b)
非劣性の成功基準:SRRの差の両側95%信頼区間下限>-10%
ワクチン接種後7日間に日誌により収集した主な副反応の発現状況は表6の
とおりであった。これらの事象はほとんどが軽度又は中等度で、接種後数
日以内に消失した4)。
日以内に消失した5)。
-3-