よむ、つかう、まなぶ。
参考資料5 新型コロナワクチン「ダイチロナ筋注」(第一三共株式会社)添付文書[335KB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/newpage_00138.html |
| 出典情報 | 厚生科学審議会・薬事審議会(合同開催) 予防接種・ワクチン分科会副反応検討部会(第106回 4/14)医薬品等安全対策部会安全対策調査会(令和7年度第1回 4/14)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
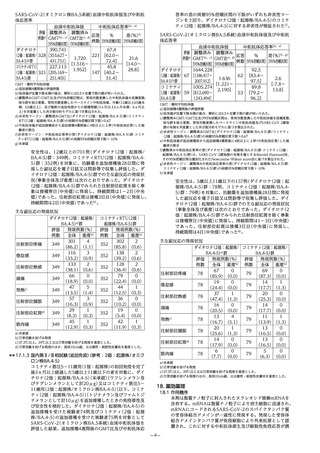
答率の差の両側95%信頼区間の下限がいずれも非劣性マー
ジンを上回り、ダイチロナ(2価:起源株/BA.4-5)のコミナ
ティ(2価:起源株/BA.4-5)に対する非劣性が検証された7)。
SARS-CoV-2(オミクロン株BA.5系統)血清中和抗体価及び中和抗
体応答率
血清中和抗体価
中和抗体応答率b)、e)
評価 調整済み 調整済み
f)
応答
%
差(%)
例数a) GMTb)、c) GMT比c)、d)
例数 [95%信頼区間][95%信頼区間]
[95%信頼区間][95%信頼区間]
67.4
ダイチロナ
390.741
221 [62.0~
(2価:起源株/ 328[353.627~
21.6
1.720
72.4]
BA.4-5)g)群
431.751]
[14.0~
[1.516~
コミナティRTU
227.113
45.8
28.8]
1.952]
(2価:起源株/ 321[205.169~
147 [40.2~
BA.4-5)群
251.405]
51.4]
GMT:幾何平均抗体価
a)追加接種4週間後の評価例数
b)抗体価が定量下限未満の場合、解析には0.5×定量下限の値が用いられた。
c)調整済みGMT/GMT比及び95%信頼区間は、常用対数変換した中和抗体価を従属変数、
投与群を独立変数、常用対数変換したベースライン中和抗体価、年齢(12歳以上65歳未
満、65歳以上)、及び最終の追加免疫からの接種間隔(3ヵ月以上6ヵ月未満、6ヵ月以
上)を共変量とした共分散分析モデルに基づき算出された。
d)非劣性マージン:調整済みGMT比(ダイチロナ(2価:起源株/BA.4-5)群/コミナティ
RTU(2価:起源株/BA.4-5)
群)の両側95%信頼区間下限>0.67
e)中和抗体価が追加接種前から追加接種4週間後に4倍以上に上昇(中和抗体応答)した被
験者の割合
f)非劣性マージン:中和抗体応答率の差(ダイチロナ(2価:起源株/BA.4-5)群-コミナ
ティRTU(2価:起源株/BA.4-5)
群)の両側95%信頼区間下限>-10%
g)未承認
安全性は、12歳以上の701例(ダイチロナ(2価:起源株/
BA.4-5)群:349例、コミナティRTU(2価:起源株/BA.45)群:352例)を対象に、治験薬を追加接種後28日間に発
現した副反応を電子日誌又は問診等で収集し評価した。ダ
イチロナ(2価:起源株/BA.4-5)群での主な副反応の発現状
況(事象全体及び重度)は次のとおりであった。ダイチロナ
(2価:起源株/BA.4-5)群でみられた注射部位紅斑を除く事
象は接種翌日(中央値)に発現し、持続期間は1~2日(中央
値)であった。注射部位紅斑は接種3日目(中央値)に発現し、
持続期間は2日
(中央値)であった6)。
主な副反応の発現状況
注射部位疼痛
倦怠感
注射部位熱感
頭痛
発熱c)
注射部位腫脹
注射部位紅斑d)
筋肉痛
ダイチロナ(2価:起源株/
BA.4-5)a)群
発現例数(%)
評価
例数
全体 重度b)
301
4
349
(86.2)(1.1)
116
3
349
(33.2)(0.9)
133
2
349
(38.1)(0.6)
66
0
349
(18.9)(0.0)
47
5
349
(13.5)(1.4)
57
3
349
(16.3)(0.9)
29
1
349
(8.3) (0.3)
45
1
349
(12.9)(0.3)
コミナティRTU(2価:
起源株/BA.4-5)群
発現例数(%)
評価
例数
全体 重度b)
302
2
352
(85.8)(0.6)
138
2
352
(39.2)(0.6)
128
2
352
(36.4)(0.6)
79
0
352
(22.4)(0.0)
44
1
352
(12.5)(0.3)
36
0
352
(10.2)(0.0)
19
0
352
(5.4) (0.0)
42
1
352
(11.9)(0.3)
a)未承認
b)日常活動を妨げる程度
c)37.5℃以上。39℃以上又は日常活動を妨げる程度を重度とした。
d)日常活動を妨げる程度のほか、長径10cm超、又は壊死・剥脱性皮膚炎を重度とした。
**17.1.3 国内第Ⅱ/Ⅲ相試験(追加免疫)
(参考:2価:起源株/オミク
ロン株BA.4-5)
コミナティ筋注5~11歳用(1価:起源株)の初回免疫を完了
後3ヵ月以上経過した5歳以上11歳以下の者を対象に、ダイ
チロナ(2価:起源株/BA.4-5)
(未承認)
(ウフレンメラン及
びテグレンメランとして計20μg)又はコミナティ筋注5~
11歳用(2価:起源株/オミクロン株BA.4-5)
(以下、コミナ
ティ(2価:起源株/BA.4-5))
(トジナメラン及びファムトジ
ナメランとして計10μg)を追加接種したときの免疫原性及
び安全性を検討した。ダイチロナ(2価:起源株/BA.4-5)の
追加接種を受けた被験者74例及びコミナティ(2価:起源
株/BA.4-5)の追加接種を受けた被験者75例を対象として
SARS-CoV-2(オミクロン株BA.5系統)血清中和抗体価を
評価した結果、追加接種4週間後のGMT比及び中和抗体応
SARS-CoV-2(オミクロン株BA.5系統)血清中和抗体価及び中和抗
体応答率
血清中和抗体価
中和抗体応答率b)、e)
評価 調整済み 調整済み
f)
、g)
応答
%
差(%)
例数a) GMTb)、c) GMT比c)、d)
例数 [95%信頼区間][95%信頼区間]
[95%信頼区間][95%信頼区間]
92.5
ダイチロナ
1644.228
62 [83.4~
(2価:起源株/ 67 [1346.417~
2.6
1.636
97.5]
BA.4-5)h)群
2007.912]
[-7.8~
[1.221~
コミナティ
1005.274
89.8
13.8]
2.190]
(2価:起源株/ 59 [812.690~
53 [79.2~
BA.4-5)群
1243.494]
96.2]
GMT:幾何平均抗体価
a)追加接種4週間後の評価例数
b)抗体価が定量下限未満の場合、解析には0.5×定量下限の値が用いられた。
c)調整済みGMT/GMT比及び95%信頼区間は、常用対数変換した中和抗体価を従属変数、
投与群を独立変数、常用対数変換したベースライン中和抗体価及びSARS-CoV-2感染
歴の有無を共変量とした共分散分析モデルに基づき算出された。
d)非劣性マージン:調整済みGMT比(ダイチロナ(2価:起源株/BA.4-5)群/コミナティ
(2価:起源株/BA.4-5)群)の両側95%信頼区間下限>0.67
e)中和抗体価が追加接種前から追加接種4週間後に4倍以上に上昇(中和抗体応答)した被
験者の割合
f)調整済み中和抗体応答率の差(ダイチロナ(2価:起源株/BA.4-5)群-コミナティ(2価:
起源株/BA.4-5)群)は、SARS-CoV-2感染歴の有無を層とするMantel-Haenszel法、
その95%信頼区間は層別化されたNewcombe-Wilson score法に基づき算出された。
g)非劣性マージン:調整済み中和抗体応答率の差(ダイチロナ(2価:起源株/BA.4-5)群コミナティ(2価:起源株/BA.4-5)群)の両側95%信頼区間下限>-10%
h)未承認
安全性は、5歳以上11歳以下の157例(ダイチロナ(2価:起
源株/BA.4-5)群:78例、コミナティ(2価:起源株/BA.45)群:79例)を対象に、治験薬を追加接種後28日間に発現
した副反応を電子日誌又は問診等で収集し評価した。ダイ
チロナ(2価:起源株/BA.4-5)群での主な副反応の発現状況
(事象全体及び重度)は次のとおりであった。ダイチロナ(2
価:起源株/BA.4-5)群でみられた注射部位紅斑を除く事象
は接種翌日(中央値)に発現し、持続期間は1~3日(中央値)
であった。注射部位紅斑は接種3日目(中央値)に発現し、
持続期間は4日(中央値)であった8)。
主な副反応の発現状況
注射部位疼痛
倦怠感
注射部位熱感
頭痛
発熱c)
注射部位腫脹
注射部位紅斑d)
筋肉痛
ダイチロナ(2価:起源株/ コミナティ(2価:起源株/
BA.4-5)a)群
BA.4-5)群
発現例数(%) 評価
発現例数(%)
評価
例数
全体 重度b) 例数
全体 重度b)
67
0
69
0
78
79
(85.9)(0.0)
(87.3)(0.0)
19
0
14
1
78
79
(24.4)(0.0)
(17.7)(1.3)
37
1
20
0
78
79
(47.4)(1.3)
(25.3)(0.0)
16
0
14
0
79
78
(20.5)(0.0)
(17.7)(0.0)
13
4
11
1
78
79
(16.7)(5.1)
(13.9)(1.3)
20
1
13
0
78
79
(25.6)(1.3)
(16.5)(0.0)
14
0
13
0
78
79
(17.9)(0.0)
(16.5)(0.0)
6
0
5
0
78
79
(7.7) (0.0)
(6.3) (0.0)
a)未承認
b)日常活動を妨げる程度
c)37.5℃以上。39℃以上又は日常活動を妨げる程度を重度とした。
d)日常活動を妨げる程度のほか、長径10cm超、又は壊死・剥脱性皮膚炎を重度とした。
18. 薬効薬理
18.1 作用機序
本剤は脂質ナノ粒子に封入されたヌクレオシド修飾mRNAを
含有する。mRNAは脂質ナノ粒子により宿主細胞に送達され、
mRNAにコードされるSARS-CoV-2のスパイクタンパク質
の受容体結合ドメインが一過性に発現する。発現した受容体
結合ドメインタンパク質が免疫細胞により外来抗原として認
識され、これに対する中和抗体産生及び細胞性免疫応答が誘
-4-
ジンを上回り、ダイチロナ(2価:起源株/BA.4-5)のコミナ
ティ(2価:起源株/BA.4-5)に対する非劣性が検証された7)。
SARS-CoV-2(オミクロン株BA.5系統)血清中和抗体価及び中和抗
体応答率
血清中和抗体価
中和抗体応答率b)、e)
評価 調整済み 調整済み
f)
応答
%
差(%)
例数a) GMTb)、c) GMT比c)、d)
例数 [95%信頼区間][95%信頼区間]
[95%信頼区間][95%信頼区間]
67.4
ダイチロナ
390.741
221 [62.0~
(2価:起源株/ 328[353.627~
21.6
1.720
72.4]
BA.4-5)g)群
431.751]
[14.0~
[1.516~
コミナティRTU
227.113
45.8
28.8]
1.952]
(2価:起源株/ 321[205.169~
147 [40.2~
BA.4-5)群
251.405]
51.4]
GMT:幾何平均抗体価
a)追加接種4週間後の評価例数
b)抗体価が定量下限未満の場合、解析には0.5×定量下限の値が用いられた。
c)調整済みGMT/GMT比及び95%信頼区間は、常用対数変換した中和抗体価を従属変数、
投与群を独立変数、常用対数変換したベースライン中和抗体価、年齢(12歳以上65歳未
満、65歳以上)、及び最終の追加免疫からの接種間隔(3ヵ月以上6ヵ月未満、6ヵ月以
上)を共変量とした共分散分析モデルに基づき算出された。
d)非劣性マージン:調整済みGMT比(ダイチロナ(2価:起源株/BA.4-5)群/コミナティ
RTU(2価:起源株/BA.4-5)
群)の両側95%信頼区間下限>0.67
e)中和抗体価が追加接種前から追加接種4週間後に4倍以上に上昇(中和抗体応答)した被
験者の割合
f)非劣性マージン:中和抗体応答率の差(ダイチロナ(2価:起源株/BA.4-5)群-コミナ
ティRTU(2価:起源株/BA.4-5)
群)の両側95%信頼区間下限>-10%
g)未承認
安全性は、12歳以上の701例(ダイチロナ(2価:起源株/
BA.4-5)群:349例、コミナティRTU(2価:起源株/BA.45)群:352例)を対象に、治験薬を追加接種後28日間に発
現した副反応を電子日誌又は問診等で収集し評価した。ダ
イチロナ(2価:起源株/BA.4-5)群での主な副反応の発現状
況(事象全体及び重度)は次のとおりであった。ダイチロナ
(2価:起源株/BA.4-5)群でみられた注射部位紅斑を除く事
象は接種翌日(中央値)に発現し、持続期間は1~2日(中央
値)であった。注射部位紅斑は接種3日目(中央値)に発現し、
持続期間は2日
(中央値)であった6)。
主な副反応の発現状況
注射部位疼痛
倦怠感
注射部位熱感
頭痛
発熱c)
注射部位腫脹
注射部位紅斑d)
筋肉痛
ダイチロナ(2価:起源株/
BA.4-5)a)群
発現例数(%)
評価
例数
全体 重度b)
301
4
349
(86.2)(1.1)
116
3
349
(33.2)(0.9)
133
2
349
(38.1)(0.6)
66
0
349
(18.9)(0.0)
47
5
349
(13.5)(1.4)
57
3
349
(16.3)(0.9)
29
1
349
(8.3) (0.3)
45
1
349
(12.9)(0.3)
コミナティRTU(2価:
起源株/BA.4-5)群
発現例数(%)
評価
例数
全体 重度b)
302
2
352
(85.8)(0.6)
138
2
352
(39.2)(0.6)
128
2
352
(36.4)(0.6)
79
0
352
(22.4)(0.0)
44
1
352
(12.5)(0.3)
36
0
352
(10.2)(0.0)
19
0
352
(5.4) (0.0)
42
1
352
(11.9)(0.3)
a)未承認
b)日常活動を妨げる程度
c)37.5℃以上。39℃以上又は日常活動を妨げる程度を重度とした。
d)日常活動を妨げる程度のほか、長径10cm超、又は壊死・剥脱性皮膚炎を重度とした。
**17.1.3 国内第Ⅱ/Ⅲ相試験(追加免疫)
(参考:2価:起源株/オミク
ロン株BA.4-5)
コミナティ筋注5~11歳用(1価:起源株)の初回免疫を完了
後3ヵ月以上経過した5歳以上11歳以下の者を対象に、ダイ
チロナ(2価:起源株/BA.4-5)
(未承認)
(ウフレンメラン及
びテグレンメランとして計20μg)又はコミナティ筋注5~
11歳用(2価:起源株/オミクロン株BA.4-5)
(以下、コミナ
ティ(2価:起源株/BA.4-5))
(トジナメラン及びファムトジ
ナメランとして計10μg)を追加接種したときの免疫原性及
び安全性を検討した。ダイチロナ(2価:起源株/BA.4-5)の
追加接種を受けた被験者74例及びコミナティ(2価:起源
株/BA.4-5)の追加接種を受けた被験者75例を対象として
SARS-CoV-2(オミクロン株BA.5系統)血清中和抗体価を
評価した結果、追加接種4週間後のGMT比及び中和抗体応
SARS-CoV-2(オミクロン株BA.5系統)血清中和抗体価及び中和抗
体応答率
血清中和抗体価
中和抗体応答率b)、e)
評価 調整済み 調整済み
f)
、g)
応答
%
差(%)
例数a) GMTb)、c) GMT比c)、d)
例数 [95%信頼区間][95%信頼区間]
[95%信頼区間][95%信頼区間]
92.5
ダイチロナ
1644.228
62 [83.4~
(2価:起源株/ 67 [1346.417~
2.6
1.636
97.5]
BA.4-5)h)群
2007.912]
[-7.8~
[1.221~
コミナティ
1005.274
89.8
13.8]
2.190]
(2価:起源株/ 59 [812.690~
53 [79.2~
BA.4-5)群
1243.494]
96.2]
GMT:幾何平均抗体価
a)追加接種4週間後の評価例数
b)抗体価が定量下限未満の場合、解析には0.5×定量下限の値が用いられた。
c)調整済みGMT/GMT比及び95%信頼区間は、常用対数変換した中和抗体価を従属変数、
投与群を独立変数、常用対数変換したベースライン中和抗体価及びSARS-CoV-2感染
歴の有無を共変量とした共分散分析モデルに基づき算出された。
d)非劣性マージン:調整済みGMT比(ダイチロナ(2価:起源株/BA.4-5)群/コミナティ
(2価:起源株/BA.4-5)群)の両側95%信頼区間下限>0.67
e)中和抗体価が追加接種前から追加接種4週間後に4倍以上に上昇(中和抗体応答)した被
験者の割合
f)調整済み中和抗体応答率の差(ダイチロナ(2価:起源株/BA.4-5)群-コミナティ(2価:
起源株/BA.4-5)群)は、SARS-CoV-2感染歴の有無を層とするMantel-Haenszel法、
その95%信頼区間は層別化されたNewcombe-Wilson score法に基づき算出された。
g)非劣性マージン:調整済み中和抗体応答率の差(ダイチロナ(2価:起源株/BA.4-5)群コミナティ(2価:起源株/BA.4-5)群)の両側95%信頼区間下限>-10%
h)未承認
安全性は、5歳以上11歳以下の157例(ダイチロナ(2価:起
源株/BA.4-5)群:78例、コミナティ(2価:起源株/BA.45)群:79例)を対象に、治験薬を追加接種後28日間に発現
した副反応を電子日誌又は問診等で収集し評価した。ダイ
チロナ(2価:起源株/BA.4-5)群での主な副反応の発現状況
(事象全体及び重度)は次のとおりであった。ダイチロナ(2
価:起源株/BA.4-5)群でみられた注射部位紅斑を除く事象
は接種翌日(中央値)に発現し、持続期間は1~3日(中央値)
であった。注射部位紅斑は接種3日目(中央値)に発現し、
持続期間は4日(中央値)であった8)。
主な副反応の発現状況
注射部位疼痛
倦怠感
注射部位熱感
頭痛
発熱c)
注射部位腫脹
注射部位紅斑d)
筋肉痛
ダイチロナ(2価:起源株/ コミナティ(2価:起源株/
BA.4-5)a)群
BA.4-5)群
発現例数(%) 評価
発現例数(%)
評価
例数
全体 重度b) 例数
全体 重度b)
67
0
69
0
78
79
(85.9)(0.0)
(87.3)(0.0)
19
0
14
1
78
79
(24.4)(0.0)
(17.7)(1.3)
37
1
20
0
78
79
(47.4)(1.3)
(25.3)(0.0)
16
0
14
0
79
78
(20.5)(0.0)
(17.7)(0.0)
13
4
11
1
78
79
(16.7)(5.1)
(13.9)(1.3)
20
1
13
0
78
79
(25.6)(1.3)
(16.5)(0.0)
14
0
13
0
78
79
(17.9)(0.0)
(16.5)(0.0)
6
0
5
0
78
79
(7.7) (0.0)
(6.3) (0.0)
a)未承認
b)日常活動を妨げる程度
c)37.5℃以上。39℃以上又は日常活動を妨げる程度を重度とした。
d)日常活動を妨げる程度のほか、長径10cm超、又は壊死・剥脱性皮膚炎を重度とした。
18. 薬効薬理
18.1 作用機序
本剤は脂質ナノ粒子に封入されたヌクレオシド修飾mRNAを
含有する。mRNAは脂質ナノ粒子により宿主細胞に送達され、
mRNAにコードされるSARS-CoV-2のスパイクタンパク質
の受容体結合ドメインが一過性に発現する。発現した受容体
結合ドメインタンパク質が免疫細胞により外来抗原として認
識され、これに対する中和抗体産生及び細胞性免疫応答が誘
-4-