よむ、つかう、まなぶ。
「核酸等の第一種使用等に関する専門委員会(仮)の設立について」 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_55798.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第104回 3/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
核酸等の第一種使用等に関する専門委員会(仮)の設立について
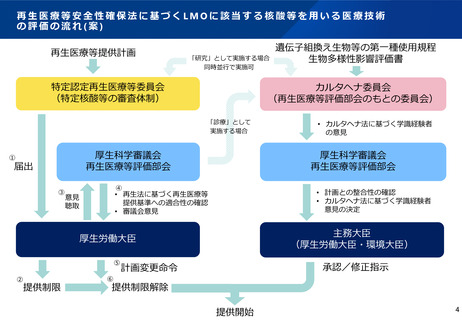
• 再生医療等安全性確保法に規定される核酸等を用いる医療技術のうち、遺伝子組換え生物等の使用等の規制による生物の多様性の確保
に関する法律(以下「カルタヘナ法」という。)における遺伝子組み換え生物等(以下「LMO」という。)の第一種使用等に該当する
もの(※)の実施に当たっては、主務大臣に対して、第一種使用規程の承認の申請を行い、承認を受けることが求められるものがあり、
研究として行われる場合には研究計画自体の審査も併せて必要となる。
(※)野外試験:LMOを屋外で試験的に使用すること。
商業栽培:LMOを商業目的で栽培すること。
環境放出:LMOを意図的に環境中に放出すること。
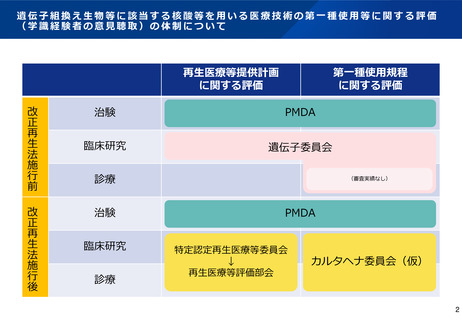
• 特定核酸等を用いる「研究」に関しては、現状、再生医療等評価部会の下に設置された「遺伝子治療等臨床研究に関する審査委員会」
(以下「遺伝子委員会」という。)において、「遺伝子治療等臨床研究に関する指針」(以下「遺伝子指針」という。)への適合性と
カルタヘナ法に基づく第一種使用規程に関する学識経験者の意見聴取(以下「評価」という。)を行っている。
※ ex vivo遺伝子治療については、遺伝子導入ウイルスの残存がない場合はカルタヘナ法上の第一種使用等に該当するものは想定されず、文部科
学省において第二種使用等に関する審査等が実施されている。
※ 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律に基づく医薬品や遺伝子治療等製品に関する審査は医薬品医療機器総合
機構(PMDA)で行われている。
• 特定核酸等を用いる「診療」については、今年5月31日以降、再生医療等の安全性の確保に関する法律(以下「安確法」という。)の
対象となることから、同法に基づく再生医療等の提供にあたっては、カルタヘナ法に基づく第一種使用規程に関する評価が必要となる。
○ 安確法に基づく再生医療等提供計画におけるカルタヘナ法の第一種使用規程の評価については、再生医療等評価部会の下に新たに「核
酸等の第一種使用等に関する専門委員会」(以下「カルタヘナ委員会」という。)を設置し、専門的な評価※を行うこととしてはどうか。
※ 再生医療等評価部会の下に設置される委員会には厚生科学審議会の議決権が委任されていないことから、決定は再生医療等評価部会で行う。
○ 安確法に基づく臨床研究は遺伝子指針に基づく遺伝子治療等臨床研究の適応外となっているが、遺伝子指針第1章の規定は引き続き有
効であるため、遺伝子委員会は存続する方針としたい。
1
• 再生医療等安全性確保法に規定される核酸等を用いる医療技術のうち、遺伝子組換え生物等の使用等の規制による生物の多様性の確保
に関する法律(以下「カルタヘナ法」という。)における遺伝子組み換え生物等(以下「LMO」という。)の第一種使用等に該当する
もの(※)の実施に当たっては、主務大臣に対して、第一種使用規程の承認の申請を行い、承認を受けることが求められるものがあり、
研究として行われる場合には研究計画自体の審査も併せて必要となる。
(※)野外試験:LMOを屋外で試験的に使用すること。
商業栽培:LMOを商業目的で栽培すること。
環境放出:LMOを意図的に環境中に放出すること。
• 特定核酸等を用いる「研究」に関しては、現状、再生医療等評価部会の下に設置された「遺伝子治療等臨床研究に関する審査委員会」
(以下「遺伝子委員会」という。)において、「遺伝子治療等臨床研究に関する指針」(以下「遺伝子指針」という。)への適合性と
カルタヘナ法に基づく第一種使用規程に関する学識経験者の意見聴取(以下「評価」という。)を行っている。
※ ex vivo遺伝子治療については、遺伝子導入ウイルスの残存がない場合はカルタヘナ法上の第一種使用等に該当するものは想定されず、文部科
学省において第二種使用等に関する審査等が実施されている。
※ 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律に基づく医薬品や遺伝子治療等製品に関する審査は医薬品医療機器総合
機構(PMDA)で行われている。
• 特定核酸等を用いる「診療」については、今年5月31日以降、再生医療等の安全性の確保に関する法律(以下「安確法」という。)の
対象となることから、同法に基づく再生医療等の提供にあたっては、カルタヘナ法に基づく第一種使用規程に関する評価が必要となる。
○ 安確法に基づく再生医療等提供計画におけるカルタヘナ法の第一種使用規程の評価については、再生医療等評価部会の下に新たに「核
酸等の第一種使用等に関する専門委員会」(以下「カルタヘナ委員会」という。)を設置し、専門的な評価※を行うこととしてはどうか。
※ 再生医療等評価部会の下に設置される委員会には厚生科学審議会の議決権が委任されていないことから、決定は再生医療等評価部会で行う。
○ 安確法に基づく臨床研究は遺伝子指針に基づく遺伝子治療等臨床研究の適応外となっているが、遺伝子指針第1章の規定は引き続き有
効であるため、遺伝子委員会は存続する方針としたい。
1