よむ、つかう、まなぶ。
「改正再生医療等安全性確保法施行における経過措置について」 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_55798.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第104回 3/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
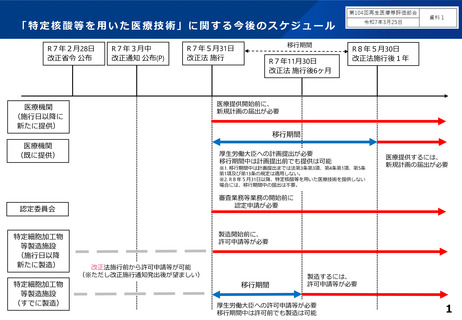
「特定核酸等を用いた医療技術」に関する今後のスケジュール
R7年2月28日
改正省令 公布
R7年3月中
改正通知 公布(P)
移行期間
R7年5月31日
改正法 施行
R7年11月30日
改正法 施行後6ヶ月
R8年5月30日
改正法施行後1年
医療提供開始前に、
新規計画の届出が必要
医療機関
(施行日以降に
新たに提供)
移行期間
医療機関
(既に提供)
厚生労働大臣への計画提出が必要
移行期間中は計画提出前でも提供は可能
※1. 移行期間中は計画提出までは法第3条第3項、第4条第1項、第5条
第1項及び第13条の規定は適用しない。
※2. R8年5月31日以降、特定核酸等を用いた医療技術を提供しない
場合には、移行期間中の提出は不要。
審査業務等業務の開始前に
認定申請が必要
認定委員会
特定細胞加工物
等製造施設
(施行日以降
新たに製造)
特定細胞加工物
等製造施設
(すでに製造)
医療提供するには、
新規計画の届出が必要
製造開始前に、
許可申請等が必要
改正法施行前から許可申請等が可能
(※ただし改正施行通知発出後が望ましい)
移行期間
製造するには、
許可申請等が必要
厚生労働大臣への許可申請等が必要
移行期間中は許可前でも製造は可能
1
R7年2月28日
改正省令 公布
R7年3月中
改正通知 公布(P)
移行期間
R7年5月31日
改正法 施行
R7年11月30日
改正法 施行後6ヶ月
R8年5月30日
改正法施行後1年
医療提供開始前に、
新規計画の届出が必要
医療機関
(施行日以降に
新たに提供)
移行期間
医療機関
(既に提供)
厚生労働大臣への計画提出が必要
移行期間中は計画提出前でも提供は可能
※1. 移行期間中は計画提出までは法第3条第3項、第4条第1項、第5条
第1項及び第13条の規定は適用しない。
※2. R8年5月31日以降、特定核酸等を用いた医療技術を提供しない
場合には、移行期間中の提出は不要。
審査業務等業務の開始前に
認定申請が必要
認定委員会
特定細胞加工物
等製造施設
(施行日以降
新たに製造)
特定細胞加工物
等製造施設
(すでに製造)
医療提供するには、
新規計画の届出が必要
製造開始前に、
許可申請等が必要
改正法施行前から許可申請等が可能
(※ただし改正施行通知発出後が望ましい)
移行期間
製造するには、
許可申請等が必要
厚生労働大臣への許可申請等が必要
移行期間中は許可前でも製造は可能
1