よむ、つかう、まなぶ。
参考資料2-1 血漿分画製剤のウイルスに対する安全性確保に関するガイドラインについて(平成11年8月) (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24719.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和3年度第6回 3/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
血漿分画製剤のウイルスに対する安全性確保に関するガイドラインについて|厚...
Page 3 of 7
な製造環境、条件及び技術を採用しなければならない。
製造工程中における原料血液以外からのウイルス汚染の可能性として以下のことが考えられる。
(1) 原材料がウイルスに汚染されている。
(2) 製造従事者より汚染される。
(3) 製造施設環境より汚染される。
(4) 製造工程において動物由来酵素やモノクローナル抗体を用いる場合、これらの試薬からウイルスが混入する。
近年の技術進歩はめざましく、有用なウイルスの検査技術や不活化及び除去技術については積極的に導入する必要がある。ウイルスの
不活化及び除去については、2つ以上の異なる工程を取り組むことが望ましい。また、医薬品と同程度の品質をもつ試薬を用いることにより、
ウイルスの混入の可能性に対する安全性を高める必要がある。
3.1 工程前検査
出発原料には一人の供血者の血液から製造された血漿、少人数の血漿をプールしたミニプール血漿及び原料プール血漿がある。一人
の供血者の血液から製造された血漿ではその特異性や感度、精度が十分に評価された試験法を用いてHCV、HBV及びHIVの血清学的検
査を行う。ミニプール血漿及び原料プール血漿についても、その特異性、感度及び精度が十分に評価された核酸増幅法検査(NAT)を用い
てHCV、HBV及びHIVの遺伝子検査を実施する。
3.2 中間血漿分画物(中間原料)の工程前検査
血漿分画製剤を製造する際に使用する原料は必ずしも血漿とは限らず、血漿由来の中間原料を原料として使用し、精製工程を経て製
品化することがある。例えば、クリオ沈殿物(血液凝固第VIII因子製剤原料)、コーンの低温エタノール分画工程から得られるPV(アルブミン
製剤原料)、PII+III(免疫グロブリン製剤原料)、PII(免疫グロブリン製剤原料)、そしてPIV―1(アンチトロンビンIII製剤原料)などの中間原料
が挙げられる。
これらの中間原料を原料とし、血漿分画製剤を製造する場合においても受け入れ試験として適切なウイルス検査を実施する必要があ
る。
なお、当該中間原料については、中間原料製造業者により、既に本ガイドラインに沿った試験が行われている必要がある。
3.3 最終製品の検査
出発原料の各種ウイルス検査の実施、製造工程におけるウイルス除去及び不活化工程を的確に実施するとともに最終製品のウイルス
検査を行う。
4 ウイルス・プロセスバリデーション
4.1 ウイルス・プロセスバリデーションの目的
ウイルス・プロセスバリデーションの目的は、原料血漿に存在する可能性のある既知のウイルス及び未知のウイルスを、製造工程で効
果的に除去及び不活化できることを検証又は推測することにある。
これは、原料血漿又は工程途中の材料に意図的にウイルスを添加し、全製造工程の除去及び不活化の効果を評価することにより達成
される。この試験により、ウイルスの有効な除去又は不活化工程が特定され、全製造工程におけるウイルスの除去及び不活化能力の推
定値が得られる。
ウイルスバリデーション試験の実施により、製剤のウイルスに関する安全性についての信頼性を高めることができる。しかし、この試験に
は多くの複雑な変動因子が関与しているので、内容が適切か否かについては個別に検討する必要がある。
4.2 ウイルスの選択
バリデーション試験に使用されるモデルウイルスとしては、広範囲にウイルス除去及び不活化の情報を得るという観点から、DNAウイル
ス及びRNAウイルス、エンベロープの有無、粒子径の大小を考慮し、さらに物理的処理及び化学的処理に対する抵抗性が高いものを選択
することが望ましい。これらの特性を網羅するには3種類程度のモデルウイルスを組み合わせることが必要になる。
原料血漿に存在している可能性のあるウイルスに類似している、あるいは同じ特性を持っているなどの理由で2種類のモデルウイルスを
選択することが可能な場合には、原則的にウイルス除去及び不活化処理に対してより抵抗性の強いウイルスを選択する。
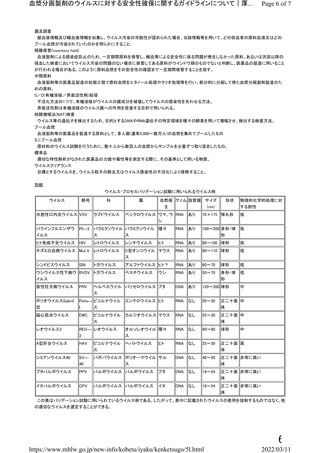
血漿分画製剤のウイルス・プロセスバリデーション試験に用いられるウイルスの例については別紙参照。
4.3 ウイルス・プロセスバリデーション試験の設計
ウイルス・プロセスバリデーション試験は、対象となる特定の製造工程段階で意図的にウイルスを添加し、当該製造工程のウイルス除去
及び不活化の能力を定量的に評価するものである。したがって、当該製剤の全ての製造工程を検証する必要はなく、ウイルスの除去及び
不活化に寄与する製造工程だけについて実施する。
バリデーションデータは、製造者がその製造工程を縮小した規模で実施した結果に基づいて作成したものを原則として使用する。いかな
るウイルスも製造施設に故意に持ち込むことはできないため、バリデーション試験は、製造設備とは別のウイルス試験設備で行わなけれ
ばならない。このため、バリデーションは、ウイルス学的研究を行う設備のある隔離された別の施設においてウイルス学の専門家と生産技
術者が共同で行う必要がある。この製造規模を縮小して行うバリデーション試験は、実生産規模での製造工程との同等性が検証されてい
ることが前提でなければならない。クロマトグラフ装置については、カラムベット高、線流速、ベット容量に対する流速の比率(すなわち接触
時間)、緩衝液、カラム充填剤の種類、pH、温度、たん白濃度、塩濃度、製品濃度に関しても、全て実生産スケールの製造に対応している
必要がある。また、溶出のプロフィールも同様のものが得られるように設計するべきである。同様な考え方をその他の工程についても適用
することが必要である。しかし、やむを得ない事情により実際の製造工程を反映させることができない場合には、それが結果にどの様な影
響を及ぼすかを考察しておくべきである。
ウイルス・プロセスバリデーション試験の計画を立案する際、検討することが望ましい留意点を以下に示す。
(1) 製造工程の設計には2つ以上の異なるウイルス不活化及び除去工程について検討することが望ましい。
(2) ウイルスを不活化及び除去することが予想される工程について、その能力を個々に評価し、それぞれが不活化工程なのか、除去工程
なのか、あるいは不活化・除去いずれにも関与しているものかを明らかにできるような試験を計画すべきである。
(3) ウイルス除去及び不活化効果に影響を及ぼす製造工程上の変動因子について検討する。
(4) ウイルスに対する抗体が出発原料に存在する場合には、ウイルス除去及び不活化工程におけるウイルスの挙動に影響を及ぼす可
能性があるので、バリデーション試験ではこのことを考慮して実施する。
3
https://www.mhlw.go.jp/new-info/kobetu/iyaku/kenketsugo/5l.html
2022/03/11
Page 3 of 7
な製造環境、条件及び技術を採用しなければならない。
製造工程中における原料血液以外からのウイルス汚染の可能性として以下のことが考えられる。
(1) 原材料がウイルスに汚染されている。
(2) 製造従事者より汚染される。
(3) 製造施設環境より汚染される。
(4) 製造工程において動物由来酵素やモノクローナル抗体を用いる場合、これらの試薬からウイルスが混入する。
近年の技術進歩はめざましく、有用なウイルスの検査技術や不活化及び除去技術については積極的に導入する必要がある。ウイルスの
不活化及び除去については、2つ以上の異なる工程を取り組むことが望ましい。また、医薬品と同程度の品質をもつ試薬を用いることにより、
ウイルスの混入の可能性に対する安全性を高める必要がある。
3.1 工程前検査
出発原料には一人の供血者の血液から製造された血漿、少人数の血漿をプールしたミニプール血漿及び原料プール血漿がある。一人
の供血者の血液から製造された血漿ではその特異性や感度、精度が十分に評価された試験法を用いてHCV、HBV及びHIVの血清学的検
査を行う。ミニプール血漿及び原料プール血漿についても、その特異性、感度及び精度が十分に評価された核酸増幅法検査(NAT)を用い
てHCV、HBV及びHIVの遺伝子検査を実施する。
3.2 中間血漿分画物(中間原料)の工程前検査
血漿分画製剤を製造する際に使用する原料は必ずしも血漿とは限らず、血漿由来の中間原料を原料として使用し、精製工程を経て製
品化することがある。例えば、クリオ沈殿物(血液凝固第VIII因子製剤原料)、コーンの低温エタノール分画工程から得られるPV(アルブミン
製剤原料)、PII+III(免疫グロブリン製剤原料)、PII(免疫グロブリン製剤原料)、そしてPIV―1(アンチトロンビンIII製剤原料)などの中間原料
が挙げられる。
これらの中間原料を原料とし、血漿分画製剤を製造する場合においても受け入れ試験として適切なウイルス検査を実施する必要があ
る。
なお、当該中間原料については、中間原料製造業者により、既に本ガイドラインに沿った試験が行われている必要がある。
3.3 最終製品の検査
出発原料の各種ウイルス検査の実施、製造工程におけるウイルス除去及び不活化工程を的確に実施するとともに最終製品のウイルス
検査を行う。
4 ウイルス・プロセスバリデーション
4.1 ウイルス・プロセスバリデーションの目的
ウイルス・プロセスバリデーションの目的は、原料血漿に存在する可能性のある既知のウイルス及び未知のウイルスを、製造工程で効
果的に除去及び不活化できることを検証又は推測することにある。
これは、原料血漿又は工程途中の材料に意図的にウイルスを添加し、全製造工程の除去及び不活化の効果を評価することにより達成
される。この試験により、ウイルスの有効な除去又は不活化工程が特定され、全製造工程におけるウイルスの除去及び不活化能力の推
定値が得られる。
ウイルスバリデーション試験の実施により、製剤のウイルスに関する安全性についての信頼性を高めることができる。しかし、この試験に
は多くの複雑な変動因子が関与しているので、内容が適切か否かについては個別に検討する必要がある。
4.2 ウイルスの選択
バリデーション試験に使用されるモデルウイルスとしては、広範囲にウイルス除去及び不活化の情報を得るという観点から、DNAウイル
ス及びRNAウイルス、エンベロープの有無、粒子径の大小を考慮し、さらに物理的処理及び化学的処理に対する抵抗性が高いものを選択
することが望ましい。これらの特性を網羅するには3種類程度のモデルウイルスを組み合わせることが必要になる。
原料血漿に存在している可能性のあるウイルスに類似している、あるいは同じ特性を持っているなどの理由で2種類のモデルウイルスを
選択することが可能な場合には、原則的にウイルス除去及び不活化処理に対してより抵抗性の強いウイルスを選択する。
血漿分画製剤のウイルス・プロセスバリデーション試験に用いられるウイルスの例については別紙参照。
4.3 ウイルス・プロセスバリデーション試験の設計
ウイルス・プロセスバリデーション試験は、対象となる特定の製造工程段階で意図的にウイルスを添加し、当該製造工程のウイルス除去
及び不活化の能力を定量的に評価するものである。したがって、当該製剤の全ての製造工程を検証する必要はなく、ウイルスの除去及び
不活化に寄与する製造工程だけについて実施する。
バリデーションデータは、製造者がその製造工程を縮小した規模で実施した結果に基づいて作成したものを原則として使用する。いかな
るウイルスも製造施設に故意に持ち込むことはできないため、バリデーション試験は、製造設備とは別のウイルス試験設備で行わなけれ
ばならない。このため、バリデーションは、ウイルス学的研究を行う設備のある隔離された別の施設においてウイルス学の専門家と生産技
術者が共同で行う必要がある。この製造規模を縮小して行うバリデーション試験は、実生産規模での製造工程との同等性が検証されてい
ることが前提でなければならない。クロマトグラフ装置については、カラムベット高、線流速、ベット容量に対する流速の比率(すなわち接触
時間)、緩衝液、カラム充填剤の種類、pH、温度、たん白濃度、塩濃度、製品濃度に関しても、全て実生産スケールの製造に対応している
必要がある。また、溶出のプロフィールも同様のものが得られるように設計するべきである。同様な考え方をその他の工程についても適用
することが必要である。しかし、やむを得ない事情により実際の製造工程を反映させることができない場合には、それが結果にどの様な影
響を及ぼすかを考察しておくべきである。
ウイルス・プロセスバリデーション試験の計画を立案する際、検討することが望ましい留意点を以下に示す。
(1) 製造工程の設計には2つ以上の異なるウイルス不活化及び除去工程について検討することが望ましい。
(2) ウイルスを不活化及び除去することが予想される工程について、その能力を個々に評価し、それぞれが不活化工程なのか、除去工程
なのか、あるいは不活化・除去いずれにも関与しているものかを明らかにできるような試験を計画すべきである。
(3) ウイルス除去及び不活化効果に影響を及ぼす製造工程上の変動因子について検討する。
(4) ウイルスに対する抗体が出発原料に存在する場合には、ウイルス除去及び不活化工程におけるウイルスの挙動に影響を及ぼす可
能性があるので、バリデーション試験ではこのことを考慮して実施する。
3
https://www.mhlw.go.jp/new-info/kobetu/iyaku/kenketsugo/5l.html
2022/03/11