よむ、つかう、まなぶ。
資料6:臨床研究法に定める疾病等報告について (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37286.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第34回 1/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第 34 回 臨床研究部会
資料6
令和6年1月 31 日
臨床研究法に定める疾病等報告について
令和6年1月 31 日
厚生労働省医政局研究開発政策課
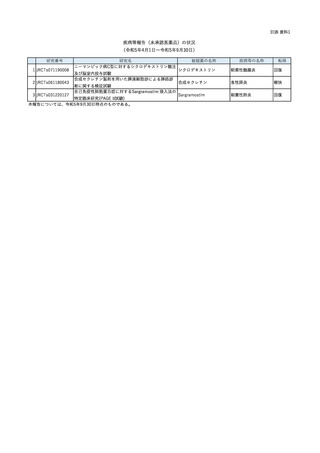
○ 臨床研究法第 15 条1項の規定により、令和5年4月から令和5
年9月末までの疾病等の報告の状況について、別紙のとおり報告
する。
〇 なお、当該報告内容に関し、認定臨床研究審査委員会から、臨床
研究の対象者の安全性に大きな影響を及ぼす疾病等や不適合への
措置として、臨床研究を中止すべき等の特記すべき意見を述べた
ものとして厚生労働大臣に報告が行われたものはなかった。
臨床研究法(抄)
(厚生科学審議会への報告)
第十五条
厚生労働大臣は、毎年度、前条の規定による報告の状況について厚生科学審議会に
報告し、必要があると認めるときは、その意見を聴いて、特定臨床研究の実施による保健衛
生上の危害の発生又は拡大を防止するために必要な措置をとらなければならない。
(略)
(機構による情報の整理及び調査の実施)
第十六条
厚生労働大臣は、独立行政法人医薬品医療機器総合機構(以下この条において「機
構」という。)に、前条第三項に規定する情報の整理を行わせることができる。
(略)
5 機構は、第一項の規定による情報の整理を行ったときは、遅滞なく、当該情報の整理の結
果を、厚生労働大臣に報告しなければならない。
(略)
資料6
令和6年1月 31 日
臨床研究法に定める疾病等報告について
令和6年1月 31 日
厚生労働省医政局研究開発政策課
○ 臨床研究法第 15 条1項の規定により、令和5年4月から令和5
年9月末までの疾病等の報告の状況について、別紙のとおり報告
する。
〇 なお、当該報告内容に関し、認定臨床研究審査委員会から、臨床
研究の対象者の安全性に大きな影響を及ぼす疾病等や不適合への
措置として、臨床研究を中止すべき等の特記すべき意見を述べた
ものとして厚生労働大臣に報告が行われたものはなかった。
臨床研究法(抄)
(厚生科学審議会への報告)
第十五条
厚生労働大臣は、毎年度、前条の規定による報告の状況について厚生科学審議会に
報告し、必要があると認めるときは、その意見を聴いて、特定臨床研究の実施による保健衛
生上の危害の発生又は拡大を防止するために必要な措置をとらなければならない。
(略)
(機構による情報の整理及び調査の実施)
第十六条
厚生労働大臣は、独立行政法人医薬品医療機器総合機構(以下この条において「機
構」という。)に、前条第三項に規定する情報の整理を行わせることができる。
(略)
5 機構は、第一項の規定による情報の整理を行ったときは、遅滞なく、当該情報の整理の結
果を、厚生労働大臣に報告しなければならない。
(略)