よむ、つかう、まなぶ。
【資料5】医薬局からの定期報告 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
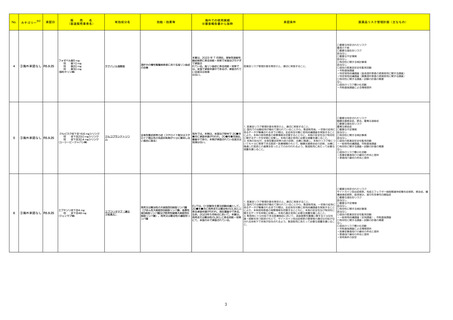
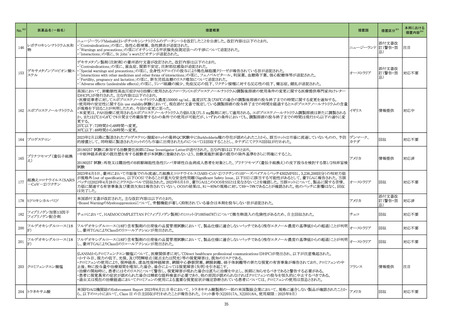
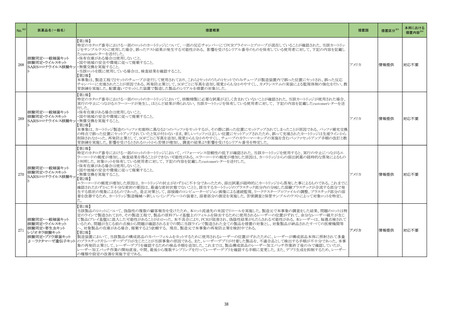
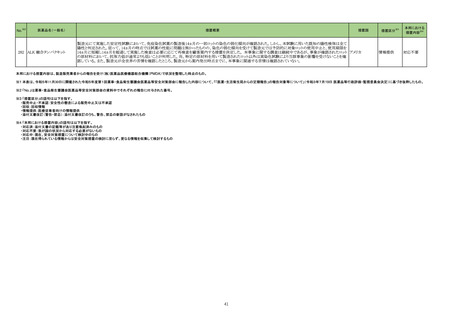
No.
4
5
6
カテゴリー
※2
承認日
③海外承認なし R5.9.25
③海外承認なし R5.9.25
③海外承認なし R5.9.25
販
売
名
(製造販売業者名)
フォゼベル錠5 mg
同
錠10 mg
同
錠20 mg
同
錠30 mg
(協和キリン㈱)
ジルビスク皮下注16.6 mgシリンジ
同
皮下注23.0 mgシリンジ
同
皮下注32.4 mgシリンジ
(ユーシービージャパン㈱)
エプキンリ皮下注4 mg
同
皮下注48 mg
(ジェンマブ㈱)
有効成分名
効能・効果等
海外での使用実績
※審査報告書から抜粋
承認条件
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
重度の下痢
○重要な潜在的リスク
該当なし
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査(血液透析患者の長期使用に関する調査)
・特定使用成績調査(腹膜透析患者の長期使用に関する調査)
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
テナパノル塩酸塩
本薬は、2023 年 7 月現在、便秘型過敏性
腸症候群に係る効能・効果で米国及びカナダ
で承認さ
透析中の慢性腎臓病患者における高リン血症
れている。高リン血症に係る効能・効果で
医薬品リスク管理計画を策定の上、適切に実施すること。
の改善
は、米国で承認申請中であるが、承認されて
いる国又は地域
はない。
ジルコプランナトリウ
ム
○重要な特定されたリスク
髄膜炎菌感染症、膵炎、重篤な過敏症
○重要な潜在的リスク
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
重篤な感染症
2. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に ○重要な不足情報
係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施すること 該当なし
海外では、本剤は、米国及び欧州で 20■年
全身型重症筋無力症(ステロイド剤又はステ
により、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性 ○有効性に関する検討事項
■月に承認申請が行われ、20■年■月現在、
ロイド剤以外の免疫抑制剤が十分に奏効しな
に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
該当なし
審査中であり、本剤が承認されている国又は
い場合に限る)
3. 本剤の投与が、全身型重症筋無力症の診断、治療に精通し、本剤のリスク等につ ○追加の医薬品安全性監視活動
地域はない。
いても十分に管理できる医師・医療機関のもとで、髄膜炎菌感染症の診断、治療に ・一般使用成績調査、市販直後調査
精通した医師との連携を取った上でのみ行われるよう、製造販売にあたって必要な ○有効性に関する調査・試験の計画の概要
措置を講じること。
なし
○追加のリスク最小化活動
・医療従事者向けの資材の作成と提供
・患者向け資材の作成と提供
エプコリタマブ(遺伝
子組換え)
再発又は難治性の大細胞型B細胞リンパ腫
(びまん性大細胞型B細胞リンパ腫、高悪性
度B細胞リンパ腫及び原発性縦隔大細胞型B
細胞リンパ腫)、再発又は難治性の濾胞性リ
ンパ腫
EUでは、01試験を主要な試験成績として、
20■年■月に再発または難治性のDLBCLに
係る承認申請が行われ、現在審査中である。
なお、2023年5月時点において、本薬は、
再発または難治性のLBCLに係る効能・効果
にて、米国のみで承認されている。
3
○重要な特定されたリスク
サイトカイン放出症候群、免疫エフェクター細胞関連神経毒性症候群、感染症、腫
瘍崩壊症候群、血球減少、進行性多巣性白質脳症
○重要な潜在的リスク
該当なし
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
○重要な不足情報
2. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に
該当なし
係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施すること
○有効性に関する検討事項
により、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に
該当なし
関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
○追加の医薬品安全性監視活動
3. 緊急時に十分対応できる医療施設において、造血器悪性腫瘍に関する十分な知
・一般使用成績調査(全例調査)、市販直後調査
識・経験を持つ医師のもとで、サイトカイン放出症候群の管理等の適切な対応がな
○有効性に関する調査・試験の計画の概要
される体制下で本剤が投与されるよう、製造販売にあたって必要な措置を講じるこ
なし
と。
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向けの資材の作成と提供
・患者向け資材の作成と提供
・使用条件の設定
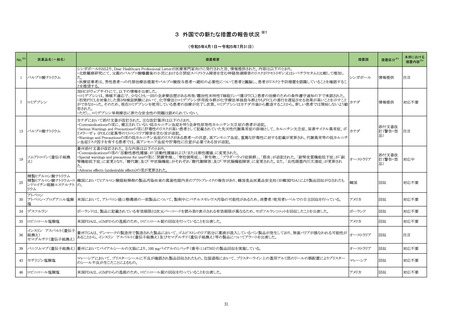
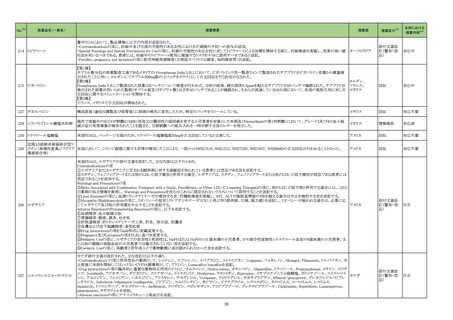
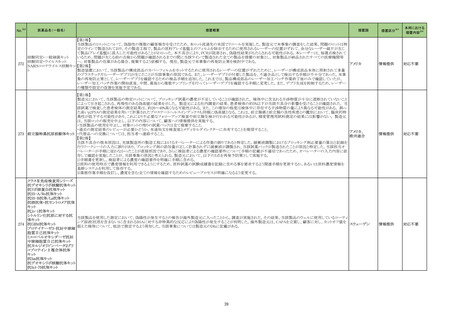
4
5
6
カテゴリー
※2
承認日
③海外承認なし R5.9.25
③海外承認なし R5.9.25
③海外承認なし R5.9.25
販
売
名
(製造販売業者名)
フォゼベル錠5 mg
同
錠10 mg
同
錠20 mg
同
錠30 mg
(協和キリン㈱)
ジルビスク皮下注16.6 mgシリンジ
同
皮下注23.0 mgシリンジ
同
皮下注32.4 mgシリンジ
(ユーシービージャパン㈱)
エプキンリ皮下注4 mg
同
皮下注48 mg
(ジェンマブ㈱)
有効成分名
効能・効果等
海外での使用実績
※審査報告書から抜粋
承認条件
医薬品リスク管理計画(主なもの)
○重要な特定されたリスク
重度の下痢
○重要な潜在的リスク
該当なし
○重要な不足情報
該当なし
○有効性に関する検討事項
該当なし
○追加の医薬品安全性監視活動
・市販直後調査
・特定使用成績調査(血液透析患者の長期使用に関する調査)
・特定使用成績調査(腹膜透析患者の長期使用に関する調査)
○有効性に関する調査・試験の計画の概要
なし
○追加のリスク最小化活動
・市販直後調査による情報提供
テナパノル塩酸塩
本薬は、2023 年 7 月現在、便秘型過敏性
腸症候群に係る効能・効果で米国及びカナダ
で承認さ
透析中の慢性腎臓病患者における高リン血症
れている。高リン血症に係る効能・効果で
医薬品リスク管理計画を策定の上、適切に実施すること。
の改善
は、米国で承認申請中であるが、承認されて
いる国又は地域
はない。
ジルコプランナトリウ
ム
○重要な特定されたリスク
髄膜炎菌感染症、膵炎、重篤な過敏症
○重要な潜在的リスク
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
重篤な感染症
2. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に ○重要な不足情報
係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施すること 該当なし
海外では、本剤は、米国及び欧州で 20■年
全身型重症筋無力症(ステロイド剤又はステ
により、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性 ○有効性に関する検討事項
■月に承認申請が行われ、20■年■月現在、
ロイド剤以外の免疫抑制剤が十分に奏効しな
に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
該当なし
審査中であり、本剤が承認されている国又は
い場合に限る)
3. 本剤の投与が、全身型重症筋無力症の診断、治療に精通し、本剤のリスク等につ ○追加の医薬品安全性監視活動
地域はない。
いても十分に管理できる医師・医療機関のもとで、髄膜炎菌感染症の診断、治療に ・一般使用成績調査、市販直後調査
精通した医師との連携を取った上でのみ行われるよう、製造販売にあたって必要な ○有効性に関する調査・試験の計画の概要
措置を講じること。
なし
○追加のリスク最小化活動
・医療従事者向けの資材の作成と提供
・患者向け資材の作成と提供
エプコリタマブ(遺伝
子組換え)
再発又は難治性の大細胞型B細胞リンパ腫
(びまん性大細胞型B細胞リンパ腫、高悪性
度B細胞リンパ腫及び原発性縦隔大細胞型B
細胞リンパ腫)、再発又は難治性の濾胞性リ
ンパ腫
EUでは、01試験を主要な試験成績として、
20■年■月に再発または難治性のDLBCLに
係る承認申請が行われ、現在審査中である。
なお、2023年5月時点において、本薬は、
再発または難治性のLBCLに係る効能・効果
にて、米国のみで承認されている。
3
○重要な特定されたリスク
サイトカイン放出症候群、免疫エフェクター細胞関連神経毒性症候群、感染症、腫
瘍崩壊症候群、血球減少、進行性多巣性白質脳症
○重要な潜在的リスク
該当なし
1. 医薬品リスク管理計画を策定の上、適切に実施すること。
○重要な不足情報
2. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に
該当なし
係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施すること
○有効性に関する検討事項
により、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に
該当なし
関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
○追加の医薬品安全性監視活動
3. 緊急時に十分対応できる医療施設において、造血器悪性腫瘍に関する十分な知
・一般使用成績調査(全例調査)、市販直後調査
識・経験を持つ医師のもとで、サイトカイン放出症候群の管理等の適切な対応がな
○有効性に関する調査・試験の計画の概要
される体制下で本剤が投与されるよう、製造販売にあたって必要な措置を講じるこ
なし
と。
○追加のリスク最小化活動
・市販直後調査による情報提供
・医療従事者向けの資材の作成と提供
・患者向け資材の作成と提供
・使用条件の設定