よむ、つかう、まなぶ。
10参考資料1-5_MSD株式会社提出資料(第21回ワクチン評価に関する小委員会 資料1-2) (34 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36952.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 予防接種基本方針部会(第58回 12/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
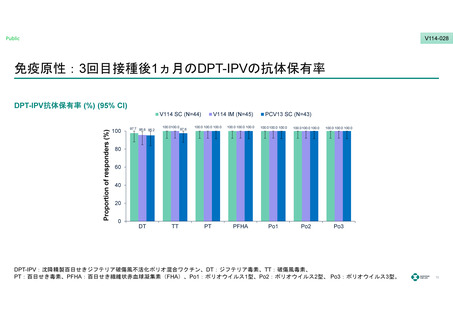
V114-028
Public
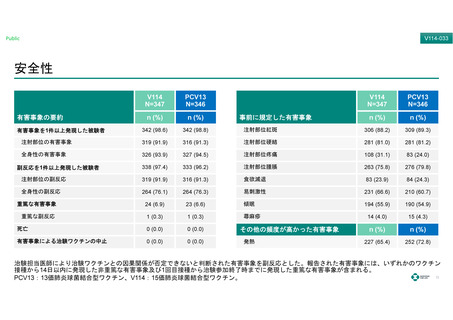
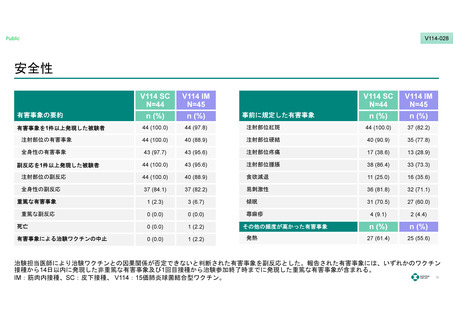
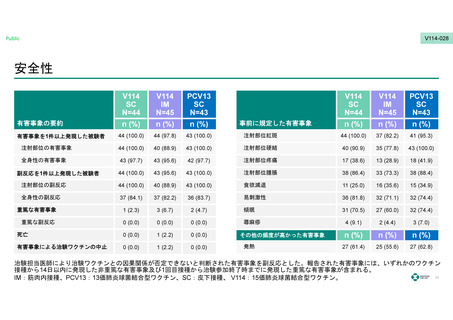
安全性
V114
SC
N=44
V114
IM
N=45
PCV13
SC
N=43
V114
SC
N=44
V114
IM
N=45
PCV13
SC
N=43
有害事象の要約
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
有害事象を1件以上発現した被験者
44 (100.0)
44 (97.8)
43 (100.0)
注射部位紅斑
44 (100.0)
37 (82.2)
41 (95.3)
注射部位の有害事象
44 (100.0)
40 (88.9)
43 (100.0)
注射部位硬結
40 (90.9)
35 (77.8)
43 (100.0)
全身性の有害事象
43 (97.7)
43 (95.6)
42 (97.7)
注射部位疼痛
17 (38.6)
13 (28.9)
18 (41.9)
44 (100.0)
43 (95.6)
43 (100.0)
注射部位腫脹
38 (86.4)
33 (73.3)
38 (88.4)
注射部位の副反応
44 (100.0)
40 (88.9)
43 (100.0)
食欲減退
11 (25.0)
16 (35.6)
15 (34.9)
全身性の副反応
37 (84.1)
37 (82.2)
36 (83.7)
易刺激性
36 (81.8)
32 (71.1)
32 (74.4)
重篤な有害事象
1 (2.3)
3 (6.7)
2 (4.7)
傾眠
31 (70.5)
27 (60.0)
32 (74.4)
重篤な副反応
0 (0.0)
0 (0.0)
0 (0.0)
蕁麻疹
4 (9.1)
2 (4.4)
3 (7.0)
死亡
0 (0.0)
1 (2.2)
0 (0.0)
その他の頻度が高かった有害事象
n (%)
n (%)
n (%)
有害事象による治験ワクチンの中止
0 (0.0)
1 (2.2)
0 (0.0)
発熱
27 (61.4)
25 (55.6)
27 (62.8)
副反応を1件以上発現した被験者
事前に規定した有害事象
治験担当医師により治験ワクチンとの因果関係が否定できないと判断された有害事象を副反応とした。報告された有害事象には、いずれかのワクチン
接種から14日以内に発現した非重篤な有害事象及び1回目接種から治験参加終了時までに発現した重篤な有害事象が含まれる。
34
IM:筋肉内接種、PCV13:13価肺炎球菌結合型ワクチン、SC:皮下接種、 V114:15価肺炎球菌結合型ワクチン。
Public
安全性
V114
SC
N=44
V114
IM
N=45
PCV13
SC
N=43
V114
SC
N=44
V114
IM
N=45
PCV13
SC
N=43
有害事象の要約
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
有害事象を1件以上発現した被験者
44 (100.0)
44 (97.8)
43 (100.0)
注射部位紅斑
44 (100.0)
37 (82.2)
41 (95.3)
注射部位の有害事象
44 (100.0)
40 (88.9)
43 (100.0)
注射部位硬結
40 (90.9)
35 (77.8)
43 (100.0)
全身性の有害事象
43 (97.7)
43 (95.6)
42 (97.7)
注射部位疼痛
17 (38.6)
13 (28.9)
18 (41.9)
44 (100.0)
43 (95.6)
43 (100.0)
注射部位腫脹
38 (86.4)
33 (73.3)
38 (88.4)
注射部位の副反応
44 (100.0)
40 (88.9)
43 (100.0)
食欲減退
11 (25.0)
16 (35.6)
15 (34.9)
全身性の副反応
37 (84.1)
37 (82.2)
36 (83.7)
易刺激性
36 (81.8)
32 (71.1)
32 (74.4)
重篤な有害事象
1 (2.3)
3 (6.7)
2 (4.7)
傾眠
31 (70.5)
27 (60.0)
32 (74.4)
重篤な副反応
0 (0.0)
0 (0.0)
0 (0.0)
蕁麻疹
4 (9.1)
2 (4.4)
3 (7.0)
死亡
0 (0.0)
1 (2.2)
0 (0.0)
その他の頻度が高かった有害事象
n (%)
n (%)
n (%)
有害事象による治験ワクチンの中止
0 (0.0)
1 (2.2)
0 (0.0)
発熱
27 (61.4)
25 (55.6)
27 (62.8)
副反応を1件以上発現した被験者
事前に規定した有害事象
治験担当医師により治験ワクチンとの因果関係が否定できないと判断された有害事象を副反応とした。報告された有害事象には、いずれかのワクチン
接種から14日以内に発現した非重篤な有害事象及び1回目接種から治験参加終了時までに発現した重篤な有害事象が含まれる。
34
IM:筋肉内接種、PCV13:13価肺炎球菌結合型ワクチン、SC:皮下接種、 V114:15価肺炎球菌結合型ワクチン。