よむ、つかう、まなぶ。
総ー1○令和6年度薬価制度改革の骨子(案)について (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00233.html |
| 出典情報 | 中央社会保険医療協議会 総会(第574回 12/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
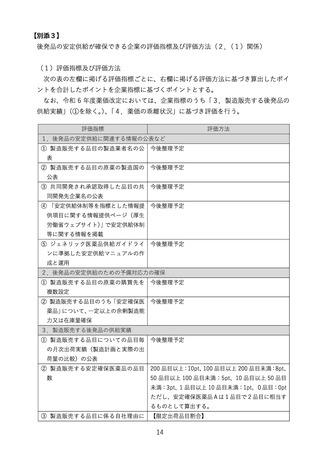
・ 承認時期が欧米より早い又は欧米で最も早い承認から 6 か月以内の品目
② 収載後の外国平均価格調整【基準改正】
○ 収載後の外国平均価格調整について、令和6年度以降に収載される品目に対して
は、現行の原価計算方式における対応に加え、類似薬効比較方式(Ⅰ)で算定され
る品目についても適用することとし、具体的には、以下に掲げる要件の全てに該当
する医薬品については、薬価改定の際に、1 回に限り、外国平均価格調整を行うこ
ととする。ただし、当該医薬品に係る後発品が薬価収載されるか、当該医薬品の薬
価収載の日から 15 年を経過するまでの間に限る。
○ 価格調整方法は、収載時の外国平均価格調整のルールに準じて対応するが、価格
の引上げに関しては、患者負担増への影響等を配慮する必要があることから、改定
前薬価の 1.20 倍を上限とすることとする。
<適用対象となる医薬品>
・原薬・製剤を輸入しているもの
・薬価収載時に参照できる外国価格がなかったもの
・薬価収載後、いずれかの外国価格が初めて掲載されたもの
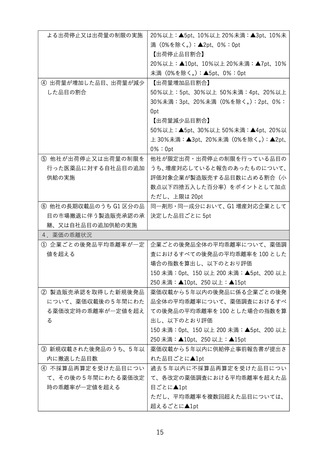
(2)新薬創出・適応外薬解消等促進加算の見直し
① 新薬創出等加算の見直し【基準改正】
新薬創出・適応外薬解消等促進加算(以下「新薬創出等加算」という。)を革新的
新薬の薬価を維持する制度とするため、以下のとおり見直すこととする。
<企業要件・企業指標>
○ 制度が試行的に導入された当初から未承認薬・適応外薬の解消等の取組を評価
する趣旨で企業の取組みを評価していたが、
・ 品目要件により革新的な医薬品を評価の対象とすることで、このような品目
の開発促進という企業側のインセンティブにつながると考えられること
・ 企業要件・企業指標は企業の規模に依存するところがあり、ベンチャー企業
やスタートアップ企業では高いポイントを得られにくい状況であること
等を考慮し、企業指標に基づく加算係数の設定(加算額の調整)については廃止
する。
〇 企業指標は廃止するが、本制度において革新的医薬品の国内開発を進めていく
趣旨を継続させるため、新薬創出等加算の対象となる企業については、現行の対
象企業の要件に加え、上記加算係数の設定に用いた企業指標に倣い別添1の項目
のとおり企業ごとの開発状況を確認し、過去5年間いずれの項目も満たさない場
合には、新薬創出等加算の加算対象外とする。
2
② 収載後の外国平均価格調整【基準改正】
○ 収載後の外国平均価格調整について、令和6年度以降に収載される品目に対して
は、現行の原価計算方式における対応に加え、類似薬効比較方式(Ⅰ)で算定され
る品目についても適用することとし、具体的には、以下に掲げる要件の全てに該当
する医薬品については、薬価改定の際に、1 回に限り、外国平均価格調整を行うこ
ととする。ただし、当該医薬品に係る後発品が薬価収載されるか、当該医薬品の薬
価収載の日から 15 年を経過するまでの間に限る。
○ 価格調整方法は、収載時の外国平均価格調整のルールに準じて対応するが、価格
の引上げに関しては、患者負担増への影響等を配慮する必要があることから、改定
前薬価の 1.20 倍を上限とすることとする。
<適用対象となる医薬品>
・原薬・製剤を輸入しているもの
・薬価収載時に参照できる外国価格がなかったもの
・薬価収載後、いずれかの外国価格が初めて掲載されたもの
(2)新薬創出・適応外薬解消等促進加算の見直し
① 新薬創出等加算の見直し【基準改正】
新薬創出・適応外薬解消等促進加算(以下「新薬創出等加算」という。)を革新的
新薬の薬価を維持する制度とするため、以下のとおり見直すこととする。
<企業要件・企業指標>
○ 制度が試行的に導入された当初から未承認薬・適応外薬の解消等の取組を評価
する趣旨で企業の取組みを評価していたが、
・ 品目要件により革新的な医薬品を評価の対象とすることで、このような品目
の開発促進という企業側のインセンティブにつながると考えられること
・ 企業要件・企業指標は企業の規模に依存するところがあり、ベンチャー企業
やスタートアップ企業では高いポイントを得られにくい状況であること
等を考慮し、企業指標に基づく加算係数の設定(加算額の調整)については廃止
する。
〇 企業指標は廃止するが、本制度において革新的医薬品の国内開発を進めていく
趣旨を継続させるため、新薬創出等加算の対象となる企業については、現行の対
象企業の要件に加え、上記加算係数の設定に用いた企業指標に倣い別添1の項目
のとおり企業ごとの開発状況を確認し、過去5年間いずれの項目も満たさない場
合には、新薬創出等加算の加算対象外とする。
2