よむ、つかう、まなぶ。
薬-1参考○令和6年度薬価制度改革の骨子(案)について (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00085.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第221回 12/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
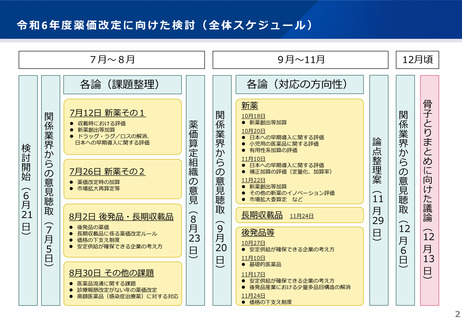
令和6年度薬価制度改革における主な改革事項
1 ドラッグ・ラグ/ドラッグ・ロス解消に向けた
革新的な医薬品のイノベーション評価
2 後発品を中心とした
医薬品の安定供給の確保のための対応
(1)日本への早期導入に関する評価
(1)後発品の安定供給が確保できる企業の考え方
・先駆加算に準じて、日本へ早期に導入した品目(優先審査品目かつ欧米での
初承認から6か月以内等の要件を満たす品目)の評価(迅速導入加算)
・収載後の外国平均価格調整における引上げの実施等
(2)新薬創出・適応外薬解消等促進加算の見直し
・加算対象期間中の薬価維持(企業区分による加算係数の廃止 等)
・対象品目の追加(小児用医薬品、迅速導入加算品)
(3)新薬の薬価収載時における評価
・有用性系加算の評価の充実
・市場性加算、小児加算等の加算率の柔軟な判断
(4)新薬の薬価改定時における評価
・複数の効能追加に対する改定時加算の充実(効能ごとに評価)
・新薬創出等加算品目に対する改定時加算の評価の充実(加算方法の変更)
(5)小児用の医薬品に関する評価
・加算率の柔軟な判断、新薬創出等加算の対象への追加
・成人開発と同時に小児開発計画を策定し、承認を得た場合の加算率引上げ
(6)新規モダリティのイノベーション評価
・原価計算方式における開示度向上については、引き続き検討
・再生医療等製品を含む新規モダリティの評価について、次期改定に向け検討
(7)その他のイノベーション評価に関する事項
・標準的治療法に位置づけられることが見込まれる品目に対する評価
・G1/ G2品目を比較薬とすることが可能となるよう見直し
(8)市場拡大再算定の見直し
・あらかじめ特定した領域について類似品としての適用を除外(R6四半期~)
(9)長期収載品における対応
・改定ルールの見直しは行わないが、長期収載品の保険給付の在り方の見直し
を踏まえ、後発品の置換え状況等を検証し、さらなる薬価上の措置を検討
・安定供給に係る企業指標の導入・評価、安定供給に係る情報の可視化
・上位評価の企業の後発品について、通常の3価格帯とは別の価格に集約
(収載後5年以内、安定確保医薬品A/B)
(2)後発品の新規収載時の価格
・同時収載される内用薬が7品目を超える場合に0.4掛け(現行:10品目超)
(3)価格の下支え制度の充実
・基礎的医薬品の対象範囲を収載から25年→15年に拡大
・不採算品再算定を企業希望の全品目に適用(乖離率が一定水準(7.0%)以下
の品目が対象)
3 その他の課題
(1)医薬品流通
・過度な薬価差の偏在も含め、医薬品流通の課題について関係会議の検討結果
を踏まえ引き続き検討
・調整幅の在り方について、上記検討を踏まえ引き続き検討
(2)診療報酬改定がない年の薬価改定
・引き続き検討(R6年度速やかに議論を開始)
(3)高額医薬品に対する対応
・市場規模が年間1,500億円を超えると見込まれる品目は、引き続き、通常の
薬価算定に先立ち中医協総会で薬価算定方法を議論
<薬価制度改革の検証等>
・革新的新薬の創出、ドラッグ・ラグ/ドラッグ・ロス解消等の医薬品開発に
対する影響を製薬業界の協力のもとで分析・評価等を行い、革新的新薬の薬価
の在り方を引き続き議論
・医薬品の安定供給確保に向けて、今回の企業指標・評価方法の妥当性等を検
証し、安定供給が確保できる企業の考え方や評価結果の薬価制度における取扱
いを引き続き議論
4
1 ドラッグ・ラグ/ドラッグ・ロス解消に向けた
革新的な医薬品のイノベーション評価
2 後発品を中心とした
医薬品の安定供給の確保のための対応
(1)日本への早期導入に関する評価
(1)後発品の安定供給が確保できる企業の考え方
・先駆加算に準じて、日本へ早期に導入した品目(優先審査品目かつ欧米での
初承認から6か月以内等の要件を満たす品目)の評価(迅速導入加算)
・収載後の外国平均価格調整における引上げの実施等
(2)新薬創出・適応外薬解消等促進加算の見直し
・加算対象期間中の薬価維持(企業区分による加算係数の廃止 等)
・対象品目の追加(小児用医薬品、迅速導入加算品)
(3)新薬の薬価収載時における評価
・有用性系加算の評価の充実
・市場性加算、小児加算等の加算率の柔軟な判断
(4)新薬の薬価改定時における評価
・複数の効能追加に対する改定時加算の充実(効能ごとに評価)
・新薬創出等加算品目に対する改定時加算の評価の充実(加算方法の変更)
(5)小児用の医薬品に関する評価
・加算率の柔軟な判断、新薬創出等加算の対象への追加
・成人開発と同時に小児開発計画を策定し、承認を得た場合の加算率引上げ
(6)新規モダリティのイノベーション評価
・原価計算方式における開示度向上については、引き続き検討
・再生医療等製品を含む新規モダリティの評価について、次期改定に向け検討
(7)その他のイノベーション評価に関する事項
・標準的治療法に位置づけられることが見込まれる品目に対する評価
・G1/ G2品目を比較薬とすることが可能となるよう見直し
(8)市場拡大再算定の見直し
・あらかじめ特定した領域について類似品としての適用を除外(R6四半期~)
(9)長期収載品における対応
・改定ルールの見直しは行わないが、長期収載品の保険給付の在り方の見直し
を踏まえ、後発品の置換え状況等を検証し、さらなる薬価上の措置を検討
・安定供給に係る企業指標の導入・評価、安定供給に係る情報の可視化
・上位評価の企業の後発品について、通常の3価格帯とは別の価格に集約
(収載後5年以内、安定確保医薬品A/B)
(2)後発品の新規収載時の価格
・同時収載される内用薬が7品目を超える場合に0.4掛け(現行:10品目超)
(3)価格の下支え制度の充実
・基礎的医薬品の対象範囲を収載から25年→15年に拡大
・不採算品再算定を企業希望の全品目に適用(乖離率が一定水準(7.0%)以下
の品目が対象)
3 その他の課題
(1)医薬品流通
・過度な薬価差の偏在も含め、医薬品流通の課題について関係会議の検討結果
を踏まえ引き続き検討
・調整幅の在り方について、上記検討を踏まえ引き続き検討
(2)診療報酬改定がない年の薬価改定
・引き続き検討(R6年度速やかに議論を開始)
(3)高額医薬品に対する対応
・市場規模が年間1,500億円を超えると見込まれる品目は、引き続き、通常の
薬価算定に先立ち中医協総会で薬価算定方法を議論
<薬価制度改革の検証等>
・革新的新薬の創出、ドラッグ・ラグ/ドラッグ・ロス解消等の医薬品開発に
対する影響を製薬業界の協力のもとで分析・評価等を行い、革新的新薬の薬価
の在り方を引き続き議論
・医薬品の安定供給確保に向けて、今回の企業指標・評価方法の妥当性等を検
証し、安定供給が確保できる企業の考え方や評価結果の薬価制度における取扱
いを引き続き議論
4