よむ、つかう、まなぶ。
○在宅自己注射について 総-8-2 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00223.html |
| 出典情報 | 中央社会保険医療協議会 総会(第564回 11/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
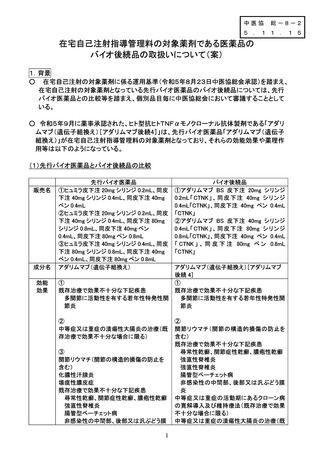
(2)バイオ後続品の治験成績等
○ アダリムマブ(遺伝子組換え)[アダリムマブ後続4](本剤)の治験成績
海外第Ⅲ相試験
中等度から重度の活動性関節リウマチ患者を対象とした無作為化、二重盲検実薬対照比較試験
を実施した。本試験ではメトトレキサート(以下、「MTX」)併用下で、本剤(40mg/0.4mLシリンジ)又
は先行バイオ医薬品(40mg/0.4mLシリンジ)40mgを隔週、48週目まで皮下投与した。また先行バイ
オ医薬品群の半数を投与26週目から本剤の投与に切替えた。有効性の主要評価項目は24週後の
ACR20達成割合とした。ACR20達成割合の差の95%信頼区間は事前に設定した同等性マージン
[-15%,15%]の範囲内であり、両剤の有効性における同等性が確認された。本剤群及び先行バイ
オ医薬品群の安全性解析対象集団のうち全試験期間における副作用の発現頻度は、本剤群で
33.6%(109/324例)及び先行バイオ医薬品群(先行バイオ医薬品から本剤に切替えた群を含む)で
39.8%(129/324例)であった。本剤群の主な副作用は、注射部位反応5.2%(17/324例)、好中球減
少症、上気道感染 各4.6%(15/324例)、白血球減少症3.7%(12/324例)、ALT増加3.4%(11/324
例)であった。
(3)先行バイオ医薬品の製造販売後の使用成績等
1)承認状況
平成20年 薬事承認
平成20年 在宅自己注射指導管理料の対象薬剤への追加
2)ヒュミラ(先行バイオ医薬品)における自己投与時の安全性
M10-877 及びM10-880 試験の併合解析46例のうち、自己投与例は22例、非自己投与例は24例
であり、自己投与集団の有害事象の発現率は、非自己投与集団を上回る傾向は認められず、自己
投与した被験者で注射に伴う有害事象は認められなかった。
3)ヒュミラ(先行バイオ医薬品)における製造販売後の安全性
特定使用成績調査における安全性解析対象例462例について、副作用発現割合は26.0%(120/462
例、200 件)であった。これは承認時までのBDの国内臨床試験における副作用発現割合70%
(14/20 例)及び承認時までのすべての国内臨床試験における副作用発現割合82.9%(1,076/1,298
例)を上回るものではなかった。
特定使用成績調査II(UCに関する長期調査)の安全性解析対象症例における副作用発現割合は
18.1%(276/1,523 例、408 件)であった。これは承認時までのUCに関する国内臨床試験における
副作用発現割合70.8%(170/240 例)と比較して、高くなる傾向は認められなかった。
2.対応案
以上から、アダリムマブ(遺伝子組換え)[アダリムマブ後続4]については、先行品と比較して、
効能効果や用法・用量等は同等であり、先行品の使用状況等にも特段の問題はないと考えら
れることから、在宅自己注射指導管理料の対象薬剤に追加してはどうか。
4
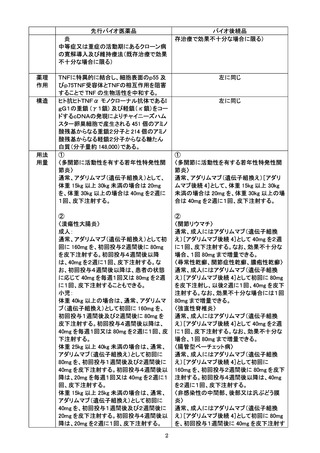
○ アダリムマブ(遺伝子組換え)[アダリムマブ後続4](本剤)の治験成績
海外第Ⅲ相試験
中等度から重度の活動性関節リウマチ患者を対象とした無作為化、二重盲検実薬対照比較試験
を実施した。本試験ではメトトレキサート(以下、「MTX」)併用下で、本剤(40mg/0.4mLシリンジ)又
は先行バイオ医薬品(40mg/0.4mLシリンジ)40mgを隔週、48週目まで皮下投与した。また先行バイ
オ医薬品群の半数を投与26週目から本剤の投与に切替えた。有効性の主要評価項目は24週後の
ACR20達成割合とした。ACR20達成割合の差の95%信頼区間は事前に設定した同等性マージン
[-15%,15%]の範囲内であり、両剤の有効性における同等性が確認された。本剤群及び先行バイ
オ医薬品群の安全性解析対象集団のうち全試験期間における副作用の発現頻度は、本剤群で
33.6%(109/324例)及び先行バイオ医薬品群(先行バイオ医薬品から本剤に切替えた群を含む)で
39.8%(129/324例)であった。本剤群の主な副作用は、注射部位反応5.2%(17/324例)、好中球減
少症、上気道感染 各4.6%(15/324例)、白血球減少症3.7%(12/324例)、ALT増加3.4%(11/324
例)であった。
(3)先行バイオ医薬品の製造販売後の使用成績等
1)承認状況
平成20年 薬事承認
平成20年 在宅自己注射指導管理料の対象薬剤への追加
2)ヒュミラ(先行バイオ医薬品)における自己投与時の安全性
M10-877 及びM10-880 試験の併合解析46例のうち、自己投与例は22例、非自己投与例は24例
であり、自己投与集団の有害事象の発現率は、非自己投与集団を上回る傾向は認められず、自己
投与した被験者で注射に伴う有害事象は認められなかった。
3)ヒュミラ(先行バイオ医薬品)における製造販売後の安全性
特定使用成績調査における安全性解析対象例462例について、副作用発現割合は26.0%(120/462
例、200 件)であった。これは承認時までのBDの国内臨床試験における副作用発現割合70%
(14/20 例)及び承認時までのすべての国内臨床試験における副作用発現割合82.9%(1,076/1,298
例)を上回るものではなかった。
特定使用成績調査II(UCに関する長期調査)の安全性解析対象症例における副作用発現割合は
18.1%(276/1,523 例、408 件)であった。これは承認時までのUCに関する国内臨床試験における
副作用発現割合70.8%(170/240 例)と比較して、高くなる傾向は認められなかった。
2.対応案
以上から、アダリムマブ(遺伝子組換え)[アダリムマブ後続4]については、先行品と比較して、
効能効果や用法・用量等は同等であり、先行品の使用状況等にも特段の問題はないと考えら
れることから、在宅自己注射指導管理料の対象薬剤に追加してはどうか。
4