よむ、つかう、まなぶ。
参考資料7 国内の利益相反管理方法の比較 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingisankakitei_shiryo_R5.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 審議参加規程評価委員会(令和5年度第1回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
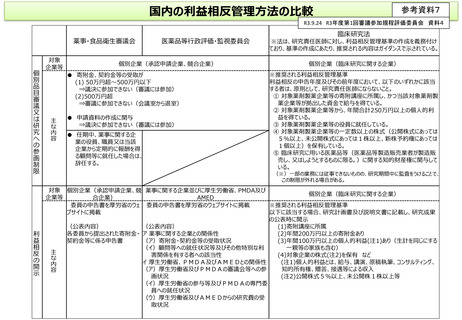
国内の利益相反管理方法の比較
参考資料7
R3.9.24 R3年度第1回審議参加規程評価委員会 資料4
薬事・食品衛生審議会
個
別
品
目
審
議
又
は
研
究
へ
の
参
画
制
限
利
益
相
反
の
開
示
対象
企業等
医薬品等行政評価・監視委員会
個別企業(承認申請企業、競合企業)
● 寄附金、契約金等の受取が
(1) 50万円超~500万円以下
⇒議決に参加できない(審議には参加)
(2)500万円超
⇒審議に参加できない(会議室から退室)
主
な
内
容
● 申請資料の作成に関与
⇒議決に参加できない(審議には参加)
● 任期中、薬事に関する企
業の役員、職員又は当該
企業から定期的に報酬を得
る顧問等に就任した場合は、
辞任する。
臨床研究法
※法は、研究責任医師に対し、利益相反管理基準の作成を義務付け
ており、基準の作成にあたり、推奨される内容はガイダンスで示されている。
個別企業(臨床研究に関する企業)
※推奨される利益相反管理基準
利益相反の申告年度及びその前年度において、以下のいずれかに該当
する者は、原則として、研究責任医師にならないこと。
① 対象薬剤製薬企業等の寄附講座に所属し、かつ当該対象薬剤製
薬企業等が拠出した資金で給与を得ている。
② 対象薬剤製薬企業等から、年間合計250万円以上の個人的利
益を得ている。
③ 対象薬剤製薬企業等の役員に就任している。
④ 対象薬剤製薬企業等の一定数以上の株式(公開株式にあっては
5%以上、未公開株式にあっては1株以上、新株予約権にあっては
1個以上)を保有している。
⑤ 臨床研究に用いる医薬品等(医薬品等製造販売業者が製造販
売し、又はしようとするものに限る。)に関する知的財産権に関与して
いる。
(※)一部の業務には従事できないものの、研究期間中に監査をうけることで、
この制限が外れる場合がある。
対象 個別企業(承認申請企業、競 薬事に関する企業並びに厚生労働省、PMDA及び
個別企業(臨床研究に関する企業)
企業等
合企業)
AMED
委員の申告書を厚労省のウェ 委員の申告書を厚労省のウェブサイトに掲載
※推奨される利益相反管理基準
ブサイトに掲載
以下に該当する場合、研究計画書及び説明文書に記載し、研究成果
の公表時に開示
(公表内容)
(公表内容)
(1)寄附講座に所属
各委員から提出された寄附金・ ア 薬事に関する企業との関係性
(2)年間200万円以上の寄附金あり
契約金等に係る申告書
(ア)寄附金・契約金等の受取状況
(3)年間100万円以上の個人的利益(注1)あり(生計を同じにする
(イ)顧問等への就任状況等及びその他特別な利
一親等の家族も含む)
主
害関係を有する者への該当性
(4)対象企業の株式(注2)を保有 など
な
イ 厚生労働省、PMDA及びAMEDとの関係性
(注1)個人的利益とは、給与、講演、原稿執筆、コンサルティング、
内
(ア)厚生労働省及びPMDAの審議会等への参
知的所有権、贈答、接遇等による収入
容
画状況
(注2)公開株式5%以上、未公開株1株以上等
(イ)厚生労働省の参与等及びPMDAの専門委
員への就任状況
(ウ)厚生労働省及びAMEDからの研究費の受
取状況
参考資料7
R3.9.24 R3年度第1回審議参加規程評価委員会 資料4
薬事・食品衛生審議会
個
別
品
目
審
議
又
は
研
究
へ
の
参
画
制
限
利
益
相
反
の
開
示
対象
企業等
医薬品等行政評価・監視委員会
個別企業(承認申請企業、競合企業)
● 寄附金、契約金等の受取が
(1) 50万円超~500万円以下
⇒議決に参加できない(審議には参加)
(2)500万円超
⇒審議に参加できない(会議室から退室)
主
な
内
容
● 申請資料の作成に関与
⇒議決に参加できない(審議には参加)
● 任期中、薬事に関する企
業の役員、職員又は当該
企業から定期的に報酬を得
る顧問等に就任した場合は、
辞任する。
臨床研究法
※法は、研究責任医師に対し、利益相反管理基準の作成を義務付け
ており、基準の作成にあたり、推奨される内容はガイダンスで示されている。
個別企業(臨床研究に関する企業)
※推奨される利益相反管理基準
利益相反の申告年度及びその前年度において、以下のいずれかに該当
する者は、原則として、研究責任医師にならないこと。
① 対象薬剤製薬企業等の寄附講座に所属し、かつ当該対象薬剤製
薬企業等が拠出した資金で給与を得ている。
② 対象薬剤製薬企業等から、年間合計250万円以上の個人的利
益を得ている。
③ 対象薬剤製薬企業等の役員に就任している。
④ 対象薬剤製薬企業等の一定数以上の株式(公開株式にあっては
5%以上、未公開株式にあっては1株以上、新株予約権にあっては
1個以上)を保有している。
⑤ 臨床研究に用いる医薬品等(医薬品等製造販売業者が製造販
売し、又はしようとするものに限る。)に関する知的財産権に関与して
いる。
(※)一部の業務には従事できないものの、研究期間中に監査をうけることで、
この制限が外れる場合がある。
対象 個別企業(承認申請企業、競 薬事に関する企業並びに厚生労働省、PMDA及び
個別企業(臨床研究に関する企業)
企業等
合企業)
AMED
委員の申告書を厚労省のウェ 委員の申告書を厚労省のウェブサイトに掲載
※推奨される利益相反管理基準
ブサイトに掲載
以下に該当する場合、研究計画書及び説明文書に記載し、研究成果
の公表時に開示
(公表内容)
(公表内容)
(1)寄附講座に所属
各委員から提出された寄附金・ ア 薬事に関する企業との関係性
(2)年間200万円以上の寄附金あり
契約金等に係る申告書
(ア)寄附金・契約金等の受取状況
(3)年間100万円以上の個人的利益(注1)あり(生計を同じにする
(イ)顧問等への就任状況等及びその他特別な利
一親等の家族も含む)
主
害関係を有する者への該当性
(4)対象企業の株式(注2)を保有 など
な
イ 厚生労働省、PMDA及びAMEDとの関係性
(注1)個人的利益とは、給与、講演、原稿執筆、コンサルティング、
内
(ア)厚生労働省及びPMDAの審議会等への参
知的所有権、贈答、接遇等による収入
容
画状況
(注2)公開株式5%以上、未公開株1株以上等
(イ)厚生労働省の参与等及びPMDAの専門委
員への就任状況
(ウ)厚生労働省及びAMEDからの研究費の受
取状況