よむ、つかう、まなぶ。
参考資料6 日米欧の審議参加ルールの比較 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingisankakitei_shiryo_R5.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 審議参加規程評価委員会(令和5年度第1回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
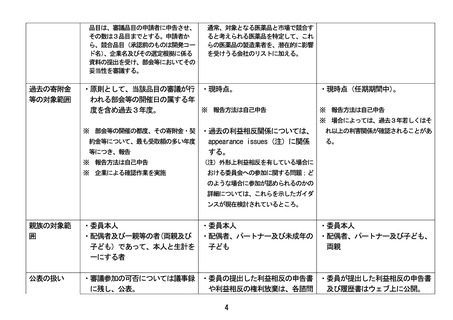
参考資料6
R3.9.24 令和3年度第1回審議参加規程評価委員会 資料3
日米欧の審議参加ルールの比較
審議参加のル
ールを規定す
る主な制度
日本(厚生労働省:薬事・食品衛生 米国(FDA:Advisory Committees) 欧州(EMA:Committee for
審議会)
Medicinal Products for Human Use
(CHMP)等)
薬事分科会審議参加規程
18 U.S.C.§208 : Acts affecting European Medicines Agency policy
(平成 20(2008)年 12 月策定)
a personal financial interest
on the handling of competing
5 CFR §2635.502 : Personal and interests of scientific
business relationships
committees’ members and experts
(令和2(2020)年6月策定)
※Guidance for the Public, FDA
Advisory Committee Members, and FDA
※ 欧州(EMA)では、加盟国の審査当局
Staff on Procedures for Determining
の職員(公務員相当)が審議会に参加して
Conflict of Interest and Eligibility おり、日米とは仕組みが異なる。
for Participation in FDA Advisory
Committees(2008 年)は 2018 年に撤回
された。
※利益相反の取扱いに関する詳細について
は現在ガイダンスの策定が検討されてい
るところ。
1
R3.9.24 令和3年度第1回審議参加規程評価委員会 資料3
日米欧の審議参加ルールの比較
審議参加のル
ールを規定す
る主な制度
日本(厚生労働省:薬事・食品衛生 米国(FDA:Advisory Committees) 欧州(EMA:Committee for
審議会)
Medicinal Products for Human Use
(CHMP)等)
薬事分科会審議参加規程
18 U.S.C.§208 : Acts affecting European Medicines Agency policy
(平成 20(2008)年 12 月策定)
a personal financial interest
on the handling of competing
5 CFR §2635.502 : Personal and interests of scientific
business relationships
committees’ members and experts
(令和2(2020)年6月策定)
※Guidance for the Public, FDA
Advisory Committee Members, and FDA
※ 欧州(EMA)では、加盟国の審査当局
Staff on Procedures for Determining
の職員(公務員相当)が審議会に参加して
Conflict of Interest and Eligibility おり、日米とは仕組みが異なる。
for Participation in FDA Advisory
Committees(2008 年)は 2018 年に撤回
された。
※利益相反の取扱いに関する詳細について
は現在ガイダンスの策定が検討されてい
るところ。
1