よむ、つかう、まなぶ。
資料3 臨床研究法におけるCOI管理のデータベース構築 (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingisankakitei_shiryo_R5.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会 審議参加規程評価委員会(令和5年度第1回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
臨床研究法におけるCOI管理のデータベース構築
資料3
◆ 臨床研究法施行5年後の見直しに係る検討のとりまとめ(令和4年6月3日 厚生科学審議会臨床研究部会)
Ⅲ 各検討項目について 革新的な医薬品等の研究開発の推進
3.(2)利益相反申告手続の適正化について
①現状と課題
○臨床研究の透明性・信頼性の向上を図る観点から、利益相反(COI)管理は重要である一方で、COIに関する現行の手続は煩雑な上に、一
部事実確認が不十分であることが指摘されている。
○具体的には、所属機関(実施医療機関)における事実確認に際して、当該機関が必ずしも所属医師等の全ての収入を把握しておらず、自
己申告によらざるを得ない場合があり、医療機関によっては実質的な確認が困難となるなど、医療機関毎に事実確認の程度が異なるとの指
摘や、医療機関の管理者等による確認の意義を問う指摘がある。
(中略)
④今後の対応の方向性
○COI管理について、医療機関における事実確認の手続を代替するための客観的かつ容易な確認や、臨床研究法における特定臨床研究のみな
らず国内の医学系研究に関するCOIの一元管理が可能となるようなデータベースを構築することが望ましい。
○国がこのようなデータベースの構築に向けた取組に着手することが期待される。
○研究における資金提供の取扱の適切性についてはCRBの判断が重要であり、CRB審議の充実を求めていくべきである。
◆ 成長戦略等のフォローアップ(令和5年6月16日 閣議決定)
Ⅱ 「GX・DX等への投資」関連のフォローアップ
3.「科学技術・イノベーション」関連
・2022 年6月の「臨床研究法5年後の見直しに係る検討の取りまとめ」を踏まえ、臨床研究法改正案を早期に国会提出するとともに、臨床
研究等での利益相反関係を管理するためのデータベースを 2024 年度までに構築する。
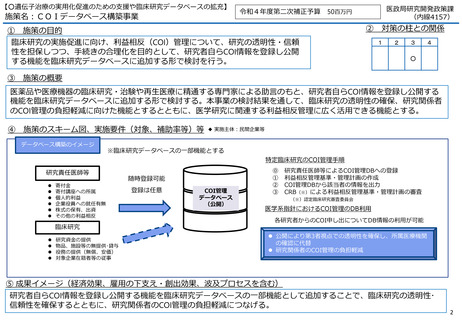
⇒令和4年度第2次補正予算による事業(次ページ参照)により、COIを一元管理するデータベースを構築するため
の仕様を検討している。
1
資料3
◆ 臨床研究法施行5年後の見直しに係る検討のとりまとめ(令和4年6月3日 厚生科学審議会臨床研究部会)
Ⅲ 各検討項目について 革新的な医薬品等の研究開発の推進
3.(2)利益相反申告手続の適正化について
①現状と課題
○臨床研究の透明性・信頼性の向上を図る観点から、利益相反(COI)管理は重要である一方で、COIに関する現行の手続は煩雑な上に、一
部事実確認が不十分であることが指摘されている。
○具体的には、所属機関(実施医療機関)における事実確認に際して、当該機関が必ずしも所属医師等の全ての収入を把握しておらず、自
己申告によらざるを得ない場合があり、医療機関によっては実質的な確認が困難となるなど、医療機関毎に事実確認の程度が異なるとの指
摘や、医療機関の管理者等による確認の意義を問う指摘がある。
(中略)
④今後の対応の方向性
○COI管理について、医療機関における事実確認の手続を代替するための客観的かつ容易な確認や、臨床研究法における特定臨床研究のみな
らず国内の医学系研究に関するCOIの一元管理が可能となるようなデータベースを構築することが望ましい。
○国がこのようなデータベースの構築に向けた取組に着手することが期待される。
○研究における資金提供の取扱の適切性についてはCRBの判断が重要であり、CRB審議の充実を求めていくべきである。
◆ 成長戦略等のフォローアップ(令和5年6月16日 閣議決定)
Ⅱ 「GX・DX等への投資」関連のフォローアップ
3.「科学技術・イノベーション」関連
・2022 年6月の「臨床研究法5年後の見直しに係る検討の取りまとめ」を踏まえ、臨床研究法改正案を早期に国会提出するとともに、臨床
研究等での利益相反関係を管理するためのデータベースを 2024 年度までに構築する。
⇒令和4年度第2次補正予算による事業(次ページ参照)により、COIを一元管理するデータベースを構築するため
の仕様を検討している。
1