よむ、つかう、まなぶ。
薬ー1○高額医薬品(認知症薬)に対する対応について (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212451_00074.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第210回 10/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
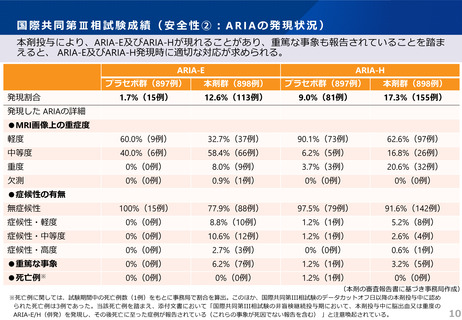
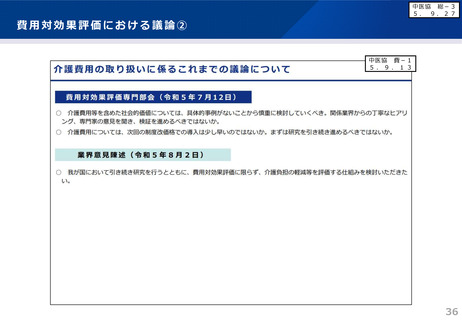
市販後における対応(全例調査)
※緑色マーカー記載は添付文書(案)等の薬事上でも規定されているもの。
本剤の承認審査において、製造販売後、一定の症例に係るデータが集積されるまでの間は、本剤
が投与された全症例を対象とした調査を実施することが適切であると判断されている。
■承認条件(抜粋)
製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査
を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性
に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
調査の概要(特定使用成績調査計画の骨子案)
目的
使用実態下における安全性及び有効性の確認
対象患者
本剤を初めて投与されるアルツハイマー病による軽度認知障害患者及び軽度の認知
症患者
観察期間
18か月間
本剤を継続投与する場合は可能な限り最長3年間の追跡調査
予定症例数
予定登録期間(18~36か月※)完了までに登録される症例数
※調査への患者の登録状況等を踏まえ、必要に応じて見直しを行う。
主な調査項目
ARIA-E、ARIA-H、患者背景(性別、年齢、既往歴・併存症、疾患ステージ、ApoE
ε4保因状況等)、抗血栓薬の併用状況、臨床症状評価(CDR-SBスコア、MMSEスコ
ア)、Aβ病理の確認方法等
11
※緑色マーカー記載は添付文書(案)等の薬事上でも規定されているもの。
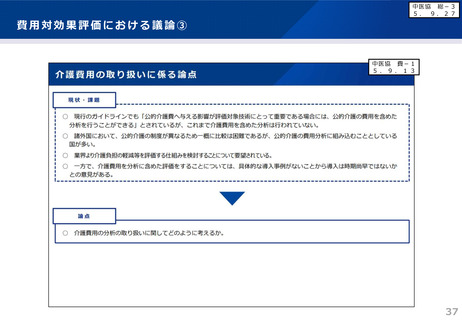
本剤の承認審査において、製造販売後、一定の症例に係るデータが集積されるまでの間は、本剤
が投与された全症例を対象とした調査を実施することが適切であると判断されている。
■承認条件(抜粋)
製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査
を実施することにより、本剤の使用患者の背景情報を把握するとともに、本剤の安全性及び有効性
に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
調査の概要(特定使用成績調査計画の骨子案)
目的
使用実態下における安全性及び有効性の確認
対象患者
本剤を初めて投与されるアルツハイマー病による軽度認知障害患者及び軽度の認知
症患者
観察期間
18か月間
本剤を継続投与する場合は可能な限り最長3年間の追跡調査
予定症例数
予定登録期間(18~36か月※)完了までに登録される症例数
※調査への患者の登録状況等を踏まえ、必要に応じて見直しを行う。
主な調査項目
ARIA-E、ARIA-H、患者背景(性別、年齢、既往歴・併存症、疾患ステージ、ApoE
ε4保因状況等)、抗血栓薬の併用状況、臨床症状評価(CDR-SBスコア、MMSEスコ
ア)、Aβ病理の確認方法等
11