よむ、つかう、まなぶ。
総-3○高額医薬品(認知症薬)に対する対応について (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00211.html |
| 出典情報 | 中央社会保険医療協議会 総会(第556回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
最適使用推進ガイドラインについて
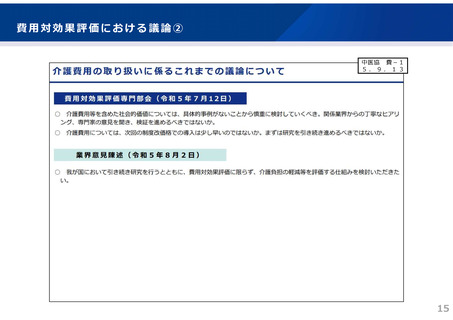
〇 本剤は認知症に対する新規作用機序の医薬品であり、臨床試験における有効性及び安全性を踏
まえ、適切な患者選択や投与判断、重篤な副作用発現(特に、アミロイド関連画像異常(ARIA)
の発現)の際の迅速な安全対策等を確保した上で、最適な薬物療法を提供できるように進めてい
く必要があることから、添付文書に加えて、最適使用推進ガイドラインを作成することとしてい
る。
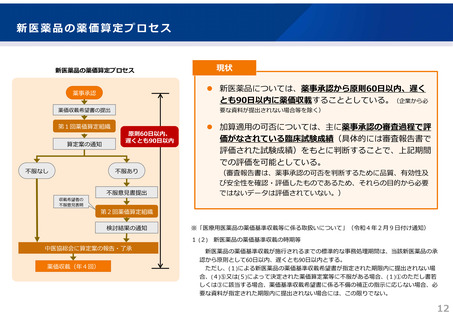
〇 ガイドラインでは、投与開始にあたり、患者要件(投与開始にあたり禁忌に該当しないことの
確認、認知症のスコア評価、アミロイドβ病理を示唆する所見の確認など)とともに、医師・施設
の要件(診断やARIAの画像所見の判断等ができる医師、必要なスコア評価やARIA判断等ができる
チーム体制や検査体制等を有する施設)を定める予定。
〇 また、投与開始後は、
・ 有効性の確認として、6か月に1回、臨床症状の確認を行い、投与継続の可否を判断
・ 安全性の確認として、本剤投与後、2か月、3か月、6か月、以降6か月に1回、MRI検査を実
施し、ARIA発現の有無を確認
することを求める予定。
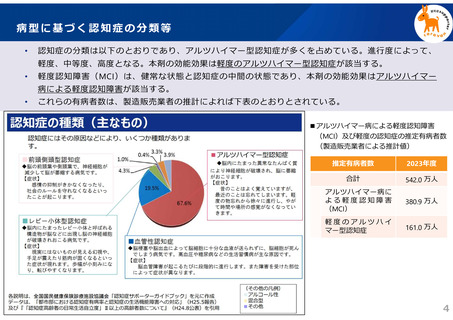
〇 したがって、「アルツハイマー病による軽度認知障害及び軽度の認知症」の推定有病者数は多
いものの、現時点のガイドラインを踏まえると、本剤の投与対象となる患者数は限定的になる見
込みである。
5
〇 本剤は認知症に対する新規作用機序の医薬品であり、臨床試験における有効性及び安全性を踏
まえ、適切な患者選択や投与判断、重篤な副作用発現(特に、アミロイド関連画像異常(ARIA)
の発現)の際の迅速な安全対策等を確保した上で、最適な薬物療法を提供できるように進めてい
く必要があることから、添付文書に加えて、最適使用推進ガイドラインを作成することとしてい
る。
〇 ガイドラインでは、投与開始にあたり、患者要件(投与開始にあたり禁忌に該当しないことの
確認、認知症のスコア評価、アミロイドβ病理を示唆する所見の確認など)とともに、医師・施設
の要件(診断やARIAの画像所見の判断等ができる医師、必要なスコア評価やARIA判断等ができる
チーム体制や検査体制等を有する施設)を定める予定。
〇 また、投与開始後は、
・ 有効性の確認として、6か月に1回、臨床症状の確認を行い、投与継続の可否を判断
・ 安全性の確認として、本剤投与後、2か月、3か月、6か月、以降6か月に1回、MRI検査を実
施し、ARIA発現の有無を確認
することを求める予定。
〇 したがって、「アルツハイマー病による軽度認知障害及び軽度の認知症」の推定有病者数は多
いものの、現時点のガイドラインを踏まえると、本剤の投与対象となる患者数は限定的になる見
込みである。
5