よむ、つかう、まなぶ。
資 料 2-1 血液製剤に関する医療機関からの感染症報告事例等について (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35085.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和5年度第2回 9/20)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
PMDA提出資料より血液対策課作成
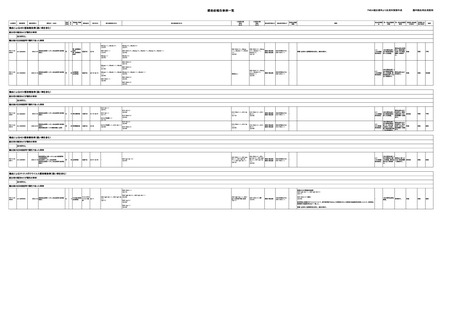
感染症報告事例一覧
日赤番号
識別番号
報告受領日
販売名(一般名)
患者 年
性別 代
原疾患(簡略
名)
感染症名
投与年月
投与前検査(年月)
投与後検査(年月)
日赤投与前
検査
(年月)
日赤投与後
検査
(年月)
受血者個別NAT
献血者個別NAT
併用血液製
剤等
備考
国内輸血用血液製剤
供血者再献 同一供血者製剤 同一供血者製剤 重篤性(担当医
血
確保
使用
の見解)
重篤性(企
業の見解)
転帰
輸血によるHBV感染報告例(疑い例を含む)
献血者の個別NATが陽性の事例
該当例なし
輸血後の抗体検査等で陽性であった事例
PDI-3-23AA-22000063
00009
照射赤血球液-LR(人赤血球液(放射線
2023/3/9
男
照射))
腎・泌尿器系
疾患
70
腎・泌尿器系
疾患
B型肝炎
22/03
HBsAg(-)、HBcAb(+)
(19/07)
HBsAg(+)、HBcAb(+)
(23/01)
HBV-DNA(-)
(19/07)
HBV-DNA(+)、HBsAg(+)、HBsAb(-)、HBeAg(+)、HBeAb(-)
(23/02)
HBsAg(-)
(22/03)
HBcAb(+)
(23/03)
1/2
(HBV関連
検査陰性)
原料血漿は使用
1本の原料血漿、1 済み。新鮮凍結
本の新鮮凍結血 血漿-LRは医療 重篤
漿-LRを製造。
機関へ供給済
み。
重篤
不明
-
4/9
(HBV関連
検査陰性)
6本の原料血漿、3
本の新鮮凍結血
原料血漿は全て
漿-LRを製造。新
重篤
使用済み。
鮮凍結血漿-LRは
全て確保済み。
重篤
未回復
3名の個別NATは
HCV-RNA(-)
-
3/3
(HCV関連
検査陰性)
原料血漿は全て
2本の原料血漿、1 使用済み。新鮮
本の新鮮凍結血 凍結血漿-LRは 非重篤
漿-LRを製造。
医療機関へ供給
済み。
重篤
不明
陰性(輸血前)
陽性(輸血後)
6名の個別NATは
HCV-RNA(-)
-
3/6
(HCV関連
検査陰性)
3本の原料血漿、1
原料血漿は全て
本の新鮮凍結血
使用済み。赤血
漿-LR、2本の赤
球液-LRは全て 重篤
血球液-LRを製
医療機関へ供給
造。新鮮凍結血漿
済み。
-LRは確保済み。
重篤
軽快
HEV-RNA(+)、HEVIgA-Ab(+)、HEV-IgM陰性(輸血前)
Ab(+)、HEV-IgG-Ab
陽性(輸血後)
(+)
(23/03)
5名の個別NATは
HEV-RNA(-)
-
3/5
(HEV関連
検査陰性)
5本の原料血漿、3
本の濃厚血小板- 濃厚血小板-LR
LRを製造。原料血 は全て医療機関 非重篤
漿は全て確保済 へ供給済み。
み。
重篤
回復
-
1本の原料血漿を
使用済み。
製造。
重篤
軽快
HBV-DNA(+)、HBsAg
(-)、HBsAb(-)、HBcAb
(+)
(22/03)
HBV-DNA(+)、HBsAg
(+)、HBsAb(-)、
陽性(輸血前)
HBcAb(+)
陽性(輸血後)
(22/12)
2名の個別NATは
HBV-DNA(-)
-
(検体なし)
HBV-DNA(+)、HBsAg
(+)、HBsAb(+)、
陽性(輸血後)
HBcAb(-)
(23/05)
9名の個別NATは
HBV-DNA(-)
HCV-RNA(-)、HCV-Ab
(-)
(21/12)
HCV-RNA(+)、HCVAb(+)
(23/02)
陰性(輸血前)
陽性(輸血後)
医師・企業共に因果関係を否定し、報告対象外。
HBV-DNA(+)
(22/12)
HBsAg(-)、HBsAb(-)、HBcAb
(-)
HBV-DNA(+)
(21/04)
(23/03)
PDI-3-23AA-23000004
00014
2023/5/15
照射赤血球液-LR(人赤血球液(放射線
男
照射))
80
血液疾患
血液腫瘍
B型肝炎
22/10-22/12
HBsAg(-)、HBsAb(-)、HBcAb HBsAg(+)、HBsAb(-)、HBcAb(-)
(-)
(23/04)
(22/04)
HBV-DNA(+)
HBV-DNA(-)
(23/05)
(22/09)
HBV-DNA(+)
(23/05)
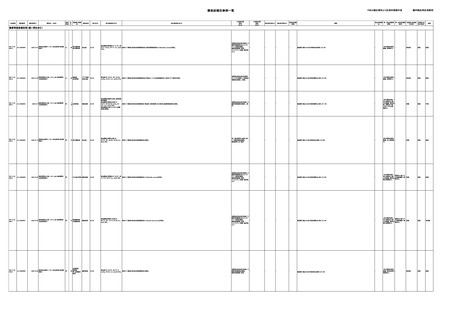
輸血によるHCV感染報告例(疑い例を含む)
献血者の個別NATが陽性の事例
該当例なし
輸血後の抗体検査等で陽性であった事例
HCV-Ab(-)
(20/01)
PDI-3-23AA-22000061
00007
照射赤血球液-LR(人赤血球液(放射線
2023/3/2
女
照射))
70 消化器腫瘍
C型肝炎
21/12-22/01
HCV-Ab(-)
(21/11)
HCVコア抗原(-)
(21/12)
PDI-3-23AA-23000008
00018
照射赤血球液-LR(人赤血球液(放射線
2023/6/27 照射))
男
新鮮凍結血漿-LR(新鮮凍結人血漿)
60 循環器疾患
C型肝炎
23/02
50 血液腫瘍
E型肝炎
23/01-23/03
HCV-Ab(+)
(23/02)
HCV-RNA(+)
(23/02)
HCV-Ab(+)
(23/06)
HCVコア抗原(-)、HCV-Ab(-)
(23/02)
HCV-RNA(+)
(23/06)
HCV-RNA(-)、HCV-Ab
(-)
(23/02)
HCV-RNA(+)、HCVAb(+)
(23/06)
輸血によるHEV感染報告例(疑い例を含む)
献血者の個別NATが陽性の事例
該当例なし
輸血後の抗体検査等で陽性であった事例
PDI-3-23AA-23000001
00011
照射濃厚血小板-LR(人血小板濃厚液
(放射線照射))
2023/4/10 赤血球液-LR(人赤血球液)
男
照射赤血球液-LR(人赤血球液(放射線
照射))
-
HEV-IgA-Ab (+)
(23/03)
HEV-RNA(-)、HEV-IgAAb(-)、HEV-IgM-Ab
(-)、HEV-IgG-Ab(-)
(22/12)
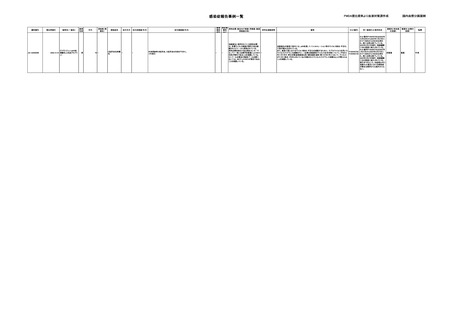
輸血によるサイトメガロウイルス感染報告例(疑い例を含む)
献血者の個別NATが陽性の事例
該当例なし
輸血後の抗体検査等で陽性であった事例
CMV-DNA(-)
(22/12)
PDI-3-23AA-22000062
00008
2023/3/2
照射赤血球液-LR(人赤血球液(放射線
女
照射))
0
サイトメガロ
その他の疾患
ウイルス感 22/11
血液疾患
染
CMV-IgM-Ab(+)、CMV-IgG-Ab(-)
CMV-IgM-Ab(-)、CMV-IgG-Ab (23/02)
(+)
(22/11)
CMV-Ag(+)
(23/02)
CMV-Ag(-)
(23/02)
母親のCMV関連検査結果
CMV-IgM-Ab(-)、CMV-IgG-Ab(+)
(22/11)
CMV-IgM-Ab(-)、CMVIgG-Ab判定不能(血清)
(22/11)
CMV-DNA(+)(尿)
(23/03)
陽性(輸血後)
1名の個別NATは
CMV-DNA(-)
-
CMV-DNA(+)(母乳)
(23/02)
重篤
患者検体と母親中のウイルスについて、超可変領域であるUL139領域及びUL146領域の塩基配列を検査したところ、患者株と
母親株の塩基配列は全て一致した。
医師・企業共に因果関係を否定し、報告対象外。
2
感染症報告事例一覧
日赤番号
識別番号
報告受領日
販売名(一般名)
患者 年
性別 代
原疾患(簡略
名)
感染症名
投与年月
投与前検査(年月)
投与後検査(年月)
日赤投与前
検査
(年月)
日赤投与後
検査
(年月)
受血者個別NAT
献血者個別NAT
併用血液製
剤等
備考
国内輸血用血液製剤
供血者再献 同一供血者製剤 同一供血者製剤 重篤性(担当医
血
確保
使用
の見解)
重篤性(企
業の見解)
転帰
輸血によるHBV感染報告例(疑い例を含む)
献血者の個別NATが陽性の事例
該当例なし
輸血後の抗体検査等で陽性であった事例
PDI-3-23AA-22000063
00009
照射赤血球液-LR(人赤血球液(放射線
2023/3/9
男
照射))
腎・泌尿器系
疾患
70
腎・泌尿器系
疾患
B型肝炎
22/03
HBsAg(-)、HBcAb(+)
(19/07)
HBsAg(+)、HBcAb(+)
(23/01)
HBV-DNA(-)
(19/07)
HBV-DNA(+)、HBsAg(+)、HBsAb(-)、HBeAg(+)、HBeAb(-)
(23/02)
HBsAg(-)
(22/03)
HBcAb(+)
(23/03)
1/2
(HBV関連
検査陰性)
原料血漿は使用
1本の原料血漿、1 済み。新鮮凍結
本の新鮮凍結血 血漿-LRは医療 重篤
漿-LRを製造。
機関へ供給済
み。
重篤
不明
-
4/9
(HBV関連
検査陰性)
6本の原料血漿、3
本の新鮮凍結血
原料血漿は全て
漿-LRを製造。新
重篤
使用済み。
鮮凍結血漿-LRは
全て確保済み。
重篤
未回復
3名の個別NATは
HCV-RNA(-)
-
3/3
(HCV関連
検査陰性)
原料血漿は全て
2本の原料血漿、1 使用済み。新鮮
本の新鮮凍結血 凍結血漿-LRは 非重篤
漿-LRを製造。
医療機関へ供給
済み。
重篤
不明
陰性(輸血前)
陽性(輸血後)
6名の個別NATは
HCV-RNA(-)
-
3/6
(HCV関連
検査陰性)
3本の原料血漿、1
原料血漿は全て
本の新鮮凍結血
使用済み。赤血
漿-LR、2本の赤
球液-LRは全て 重篤
血球液-LRを製
医療機関へ供給
造。新鮮凍結血漿
済み。
-LRは確保済み。
重篤
軽快
HEV-RNA(+)、HEVIgA-Ab(+)、HEV-IgM陰性(輸血前)
Ab(+)、HEV-IgG-Ab
陽性(輸血後)
(+)
(23/03)
5名の個別NATは
HEV-RNA(-)
-
3/5
(HEV関連
検査陰性)
5本の原料血漿、3
本の濃厚血小板- 濃厚血小板-LR
LRを製造。原料血 は全て医療機関 非重篤
漿は全て確保済 へ供給済み。
み。
重篤
回復
-
1本の原料血漿を
使用済み。
製造。
重篤
軽快
HBV-DNA(+)、HBsAg
(-)、HBsAb(-)、HBcAb
(+)
(22/03)
HBV-DNA(+)、HBsAg
(+)、HBsAb(-)、
陽性(輸血前)
HBcAb(+)
陽性(輸血後)
(22/12)
2名の個別NATは
HBV-DNA(-)
-
(検体なし)
HBV-DNA(+)、HBsAg
(+)、HBsAb(+)、
陽性(輸血後)
HBcAb(-)
(23/05)
9名の個別NATは
HBV-DNA(-)
HCV-RNA(-)、HCV-Ab
(-)
(21/12)
HCV-RNA(+)、HCVAb(+)
(23/02)
陰性(輸血前)
陽性(輸血後)
医師・企業共に因果関係を否定し、報告対象外。
HBV-DNA(+)
(22/12)
HBsAg(-)、HBsAb(-)、HBcAb
(-)
HBV-DNA(+)
(21/04)
(23/03)
PDI-3-23AA-23000004
00014
2023/5/15
照射赤血球液-LR(人赤血球液(放射線
男
照射))
80
血液疾患
血液腫瘍
B型肝炎
22/10-22/12
HBsAg(-)、HBsAb(-)、HBcAb HBsAg(+)、HBsAb(-)、HBcAb(-)
(-)
(23/04)
(22/04)
HBV-DNA(+)
HBV-DNA(-)
(23/05)
(22/09)
HBV-DNA(+)
(23/05)
輸血によるHCV感染報告例(疑い例を含む)
献血者の個別NATが陽性の事例
該当例なし
輸血後の抗体検査等で陽性であった事例
HCV-Ab(-)
(20/01)
PDI-3-23AA-22000061
00007
照射赤血球液-LR(人赤血球液(放射線
2023/3/2
女
照射))
70 消化器腫瘍
C型肝炎
21/12-22/01
HCV-Ab(-)
(21/11)
HCVコア抗原(-)
(21/12)
PDI-3-23AA-23000008
00018
照射赤血球液-LR(人赤血球液(放射線
2023/6/27 照射))
男
新鮮凍結血漿-LR(新鮮凍結人血漿)
60 循環器疾患
C型肝炎
23/02
50 血液腫瘍
E型肝炎
23/01-23/03
HCV-Ab(+)
(23/02)
HCV-RNA(+)
(23/02)
HCV-Ab(+)
(23/06)
HCVコア抗原(-)、HCV-Ab(-)
(23/02)
HCV-RNA(+)
(23/06)
HCV-RNA(-)、HCV-Ab
(-)
(23/02)
HCV-RNA(+)、HCVAb(+)
(23/06)
輸血によるHEV感染報告例(疑い例を含む)
献血者の個別NATが陽性の事例
該当例なし
輸血後の抗体検査等で陽性であった事例
PDI-3-23AA-23000001
00011
照射濃厚血小板-LR(人血小板濃厚液
(放射線照射))
2023/4/10 赤血球液-LR(人赤血球液)
男
照射赤血球液-LR(人赤血球液(放射線
照射))
-
HEV-IgA-Ab (+)
(23/03)
HEV-RNA(-)、HEV-IgAAb(-)、HEV-IgM-Ab
(-)、HEV-IgG-Ab(-)
(22/12)
輸血によるサイトメガロウイルス感染報告例(疑い例を含む)
献血者の個別NATが陽性の事例
該当例なし
輸血後の抗体検査等で陽性であった事例
CMV-DNA(-)
(22/12)
PDI-3-23AA-22000062
00008
2023/3/2
照射赤血球液-LR(人赤血球液(放射線
女
照射))
0
サイトメガロ
その他の疾患
ウイルス感 22/11
血液疾患
染
CMV-IgM-Ab(+)、CMV-IgG-Ab(-)
CMV-IgM-Ab(-)、CMV-IgG-Ab (23/02)
(+)
(22/11)
CMV-Ag(+)
(23/02)
CMV-Ag(-)
(23/02)
母親のCMV関連検査結果
CMV-IgM-Ab(-)、CMV-IgG-Ab(+)
(22/11)
CMV-IgM-Ab(-)、CMVIgG-Ab判定不能(血清)
(22/11)
CMV-DNA(+)(尿)
(23/03)
陽性(輸血後)
1名の個別NATは
CMV-DNA(-)
-
CMV-DNA(+)(母乳)
(23/02)
重篤
患者検体と母親中のウイルスについて、超可変領域であるUL139領域及びUL146領域の塩基配列を検査したところ、患者株と
母親株の塩基配列は全て一致した。
医師・企業共に因果関係を否定し、報告対象外。
2