よむ、つかう、まなぶ。
○再生医療等製品の保険適用について 総-2 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00202.html |
| 出典情報 | 中央社会保険医療協議会 総会(第552回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
製品概要
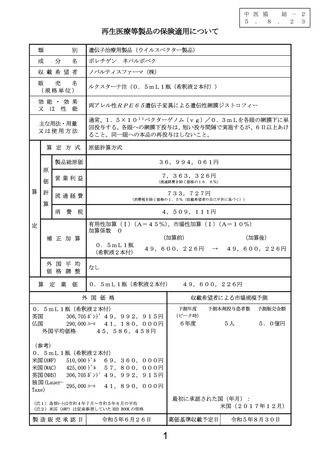
販売名
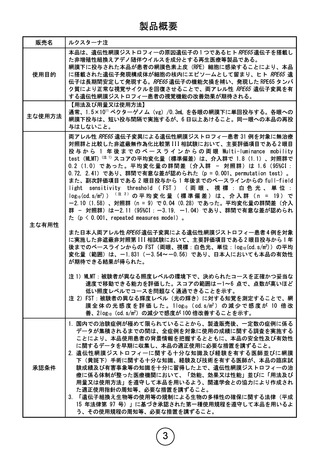
使用目的
主な使用方法
ルクスターナ注
本品は、遺伝性網膜ジストロフィーの原因遺伝子の 1 つであるヒト RPE65 遺伝子を搭載し
た非増殖性組換えアデノ随伴ウイルスを成分とする再生医療等製品である。
網膜下に投与された本品が患者の網膜色素上皮(RPE)細胞に感染することにより、本品
に搭載された遺伝子発現構成体が細胞の核内にエピソームとして留まり、ヒト RPE65 遺
伝子は長期間安定して発現する。RPE65 遺伝子の機能欠損を補い、発現した RPE65 タンパ
ク質により正常な視覚サイクルを回復させることで、両アレル性 RPE65 遺伝子変異を有
する遺伝性網膜ジストロフィー患者の視覚機能の改善効果が期待される。
【用法及び用量又は使用方法】
通常、1.5×1011 ベクターゲノム(vg)/0.3mL を各眼の網膜下に単回投与する。各眼への
網膜下投与は、短い投与間隔で実施するが、6 日以上あけること。同一眼への本品の再投
与はしないこと。
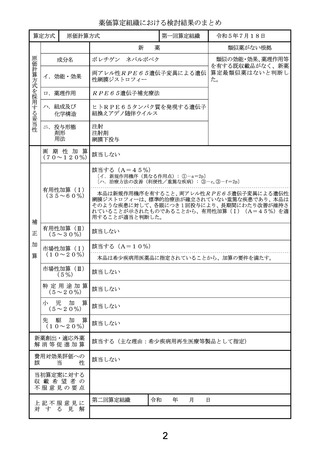
両アレル性 RPE65 遺伝子変異による遺伝性網膜ジストロフィー患者 31 例を対象に無治療
対照群と比較した非遮蔽無作為化比較第 III 相試験において、主要評価項目である 2 眼目
投 与 か ら 1 年 後 ま で の ベ ー ス ラ イ ン か ら の 両 眼 Multi-luminance mobility
test(MLMT)(注 1)スコアの平均変化量(標準偏差)は、介入群で 1.8(1.1)、対照群で
0.2 ( 1.0 )で あ った 。平 均 変化 量 の群 間差 (介 入 群 − 対照 群 ) は 1.6 ( 95%CI:
0.72, 2.41)であり、群間で有意な差が認められた(p = 0.001、permutation test)。
また、副次評価項目である 2 眼目投与から 1 年後までのベースラインからの full-field
light sensitivity threshold ( FST ) ( 両 眼 、 視 標 : 白 色 光 、 単 位 :
log10(cd.s/m2) ) ( 注 2 ) の 平 均 変 化 量 ( 標 準 偏 差 ) は 、 介 入 群 ( n = 19 ) で
-2.10(1.58)、対照群(n = 9)で 0.04(0.28)であった。平均変化量の群間差(介入
群 − 対照群)は-2.11(95%CI:-3.19,-1.04)であり、群間で有意な差が認められ
た(p < 0.001、repeated measures model)。
主な有用性
また日本人両アレル性 RPE65 遺伝子変異による遺伝性網膜ジストロフィー患者 4 例を対象
に実施した非遮蔽非対照第 III 相試験において、主要評価項目である 2 眼目投与から 1 年
後までのベースラインからの FST(両眼、視標:白色光、単位:log10(cd.s/m2))の平均
変化量(範囲)は、-1.831(-3.54~-0.56)であり、日本人においても本品の有効性
が期待できる結果が得られた。
注 1)MLMT:被験者が異なる照度レベルの環境下で、決められたコースを正確かつ妥当な
速度で移動できる能力を評価した。スコアの範囲は-1~6 点で、点数が高いほど
低い照度レベルでコースを問題なく通過できることを示す。
注 2)FST:被験者の異なる輝度レベル(光の輝き)に対する知覚を測定することで、網
膜 全 体 の 光 感 度 を 評 価 し た 。 1log10 ( cd.s/m2 ) の 減 少 で 感 度 が 10 倍 改
善、2log10(cd.s/m2)の減少で感度が 100 倍改善することを示す。
承認条件
1. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係る
データが集積されるまでの間は、全症例を対象に使用の成績に関する調査を実施する
ことにより、本品使用患者の背景情報を把握するとともに、本品の安全性及び有効性
に関するデータを早期に収集し、本品の適正使用に必要な措置を講ずること。
2. 遺伝性網膜ジストロフィーに関する十分な知識及び経験を有する医師並びに網膜
下(黄斑下)手術に関する十分な知識、経験及び技術を有する医師が、本品の臨床試
験成績及び有害事象等の知識を十分に習得した上で、遺伝性網膜ジストロフィーの治
療に係る体制が整った医療機関において、「効能、効果又は性能」並びに「用法及び
用量又は使用方法」を遵守して本品を用いるよう、関連学会との協力により作成され
た適正使用指針の周知等、必要な措置を講ずること。
3. 「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成
15 年法律第 97 号)」に基づき承認された第一種使用規程を遵守して本品を用いるよ
う、その使用規程の周知等、必要な措置を講ずること。
3
販売名
使用目的
主な使用方法
ルクスターナ注
本品は、遺伝性網膜ジストロフィーの原因遺伝子の 1 つであるヒト RPE65 遺伝子を搭載し
た非増殖性組換えアデノ随伴ウイルスを成分とする再生医療等製品である。
網膜下に投与された本品が患者の網膜色素上皮(RPE)細胞に感染することにより、本品
に搭載された遺伝子発現構成体が細胞の核内にエピソームとして留まり、ヒト RPE65 遺
伝子は長期間安定して発現する。RPE65 遺伝子の機能欠損を補い、発現した RPE65 タンパ
ク質により正常な視覚サイクルを回復させることで、両アレル性 RPE65 遺伝子変異を有
する遺伝性網膜ジストロフィー患者の視覚機能の改善効果が期待される。
【用法及び用量又は使用方法】
通常、1.5×1011 ベクターゲノム(vg)/0.3mL を各眼の網膜下に単回投与する。各眼への
網膜下投与は、短い投与間隔で実施するが、6 日以上あけること。同一眼への本品の再投
与はしないこと。
両アレル性 RPE65 遺伝子変異による遺伝性網膜ジストロフィー患者 31 例を対象に無治療
対照群と比較した非遮蔽無作為化比較第 III 相試験において、主要評価項目である 2 眼目
投 与 か ら 1 年 後 ま で の ベ ー ス ラ イ ン か ら の 両 眼 Multi-luminance mobility
test(MLMT)(注 1)スコアの平均変化量(標準偏差)は、介入群で 1.8(1.1)、対照群で
0.2 ( 1.0 )で あ った 。平 均 変化 量 の群 間差 (介 入 群 − 対照 群 ) は 1.6 ( 95%CI:
0.72, 2.41)であり、群間で有意な差が認められた(p = 0.001、permutation test)。
また、副次評価項目である 2 眼目投与から 1 年後までのベースラインからの full-field
light sensitivity threshold ( FST ) ( 両 眼 、 視 標 : 白 色 光 、 単 位 :
log10(cd.s/m2) ) ( 注 2 ) の 平 均 変 化 量 ( 標 準 偏 差 ) は 、 介 入 群 ( n = 19 ) で
-2.10(1.58)、対照群(n = 9)で 0.04(0.28)であった。平均変化量の群間差(介入
群 − 対照群)は-2.11(95%CI:-3.19,-1.04)であり、群間で有意な差が認められ
た(p < 0.001、repeated measures model)。
主な有用性
また日本人両アレル性 RPE65 遺伝子変異による遺伝性網膜ジストロフィー患者 4 例を対象
に実施した非遮蔽非対照第 III 相試験において、主要評価項目である 2 眼目投与から 1 年
後までのベースラインからの FST(両眼、視標:白色光、単位:log10(cd.s/m2))の平均
変化量(範囲)は、-1.831(-3.54~-0.56)であり、日本人においても本品の有効性
が期待できる結果が得られた。
注 1)MLMT:被験者が異なる照度レベルの環境下で、決められたコースを正確かつ妥当な
速度で移動できる能力を評価した。スコアの範囲は-1~6 点で、点数が高いほど
低い照度レベルでコースを問題なく通過できることを示す。
注 2)FST:被験者の異なる輝度レベル(光の輝き)に対する知覚を測定することで、網
膜 全 体 の 光 感 度 を 評 価 し た 。 1log10 ( cd.s/m2 ) の 減 少 で 感 度 が 10 倍 改
善、2log10(cd.s/m2)の減少で感度が 100 倍改善することを示す。
承認条件
1. 国内での治験症例が極めて限られていることから、製造販売後、一定数の症例に係る
データが集積されるまでの間は、全症例を対象に使用の成績に関する調査を実施する
ことにより、本品使用患者の背景情報を把握するとともに、本品の安全性及び有効性
に関するデータを早期に収集し、本品の適正使用に必要な措置を講ずること。
2. 遺伝性網膜ジストロフィーに関する十分な知識及び経験を有する医師並びに網膜
下(黄斑下)手術に関する十分な知識、経験及び技術を有する医師が、本品の臨床試
験成績及び有害事象等の知識を十分に習得した上で、遺伝性網膜ジストロフィーの治
療に係る体制が整った医療機関において、「効能、効果又は性能」並びに「用法及び
用量又は使用方法」を遵守して本品を用いるよう、関連学会との協力により作成され
た適正使用指針の周知等、必要な措置を講ずること。
3. 「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(平成
15 年法律第 97 号)」に基づき承認された第一種使用規程を遵守して本品を用いるよ
う、その使用規程の周知等、必要な措置を講ずること。
3