よむ、つかう、まなぶ。
参考資料2-1:臨床研究中核病院の承認要件(概要) (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34378.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第33回 8/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
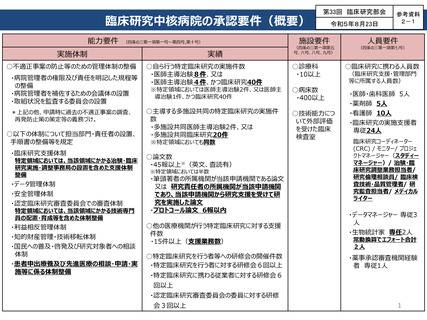
臨床研究中核病院の承認要件(概要)
能力要件 (四条の三第一項第一号~第四号,第十号)
実施体制
○不適正事案の防止等のための管理体制の整備
・病院管理者の権限及び責任を明記した規程等
の整備
・病院管理者を補佐するための会議体の設置
・取組状況を監査する委員会の設置
*上記の他、申請時に過去の不適正事案の調査、
再発防止策の策定等の義務づけ。
○以下の体制について担当部門・責任者の設置、
手順書の整備等を規定
・臨床研究支援体制
特定領域においては、当該領域にかかる治験・臨床
研究実施・調整事務局の設置を含めた支援体制
整備
・データ管理体制
・安全管理体制
・認定臨床研究審査委員会での審査体制
特定領域においては、当該領域にかかる技術専門
員の配置・育成等を含めた体制整備
・利益相反管理体制
・知的財産管理・技術移転体制
・国民への普及・啓発及び研究対象者への相談
体制
・患者申出療養及び先進医療の相談・申請・実
施等に係る体制整備
実績
○自ら行う特定臨床研究の実施件数
・医師主導治験8件、又は
・医師主導治験4件、かつ臨床研究40件
※特定領域においては医師主導治験2件、又は医師主
導治験1件、かつ臨床研究40件
○主導する多施設共同の特定臨床研究の実施件
数
・多施設共同医師主導治験2件、又は
・多施設共同臨床研究20件
※特定領域においても同数
○論文数
・45報以上※(英文、査読有)
※特定領域においては半数
・筆頭著者の所属機関が当該申請機関である論文
又は 研究責任者の所属機関が当該申請機関
であり、当該申請機関から研究支援を受けて研
究を実施した論文
・プロトコール論文 6報以内
○他の医療機関が行う特定臨床研究に対する支援
件数
・15件以上(支援業務数)
○特定臨床研究を行う者等への研修会の開催件数
・特定臨床研究を行う者に対する研修会6回以上
第33回 臨床研究部会
令和5年8月23日
参考資料
2-1
施設要件
人員要件
(四条の三第一項第五
号、六号、八号、九号)
(四条の三第一項第七号)
○診療科
・10以上
○病床数
・400以上
○技術能力につ
いて外部評価
を受けた臨床
検査室
○臨床研究に携わる人員数
(臨床研究支援・管理部門
等に所属する人員数)
・医師・歯科医師 5人
・薬剤師 5人
・看護師 10人
・臨床研究の実施支援者
専従24人
臨床研究コーディネーター
(CRC) / モニター/ プロジェ
クトマネージャー(スタディー
マネージャー)/ 治験・臨
床研究調整業務担当者/
研究倫理相談員/ 臨床検
査技術・品質管理者/ 研
究監査担当者/ メディカル
ライター
・データマネージャー 専従3
人
・生物統計家 専任2人
常勤換算でエフォート合計
2人
・薬事承認審査機関経験
者 専従1人
・特定臨床研究に携わる従業者に対する研修会6
回以上
・認定臨床研究審査委員会の委員に対する研修
会3回以上
1
能力要件 (四条の三第一項第一号~第四号,第十号)
実施体制
○不適正事案の防止等のための管理体制の整備
・病院管理者の権限及び責任を明記した規程等
の整備
・病院管理者を補佐するための会議体の設置
・取組状況を監査する委員会の設置
*上記の他、申請時に過去の不適正事案の調査、
再発防止策の策定等の義務づけ。
○以下の体制について担当部門・責任者の設置、
手順書の整備等を規定
・臨床研究支援体制
特定領域においては、当該領域にかかる治験・臨床
研究実施・調整事務局の設置を含めた支援体制
整備
・データ管理体制
・安全管理体制
・認定臨床研究審査委員会での審査体制
特定領域においては、当該領域にかかる技術専門
員の配置・育成等を含めた体制整備
・利益相反管理体制
・知的財産管理・技術移転体制
・国民への普及・啓発及び研究対象者への相談
体制
・患者申出療養及び先進医療の相談・申請・実
施等に係る体制整備
実績
○自ら行う特定臨床研究の実施件数
・医師主導治験8件、又は
・医師主導治験4件、かつ臨床研究40件
※特定領域においては医師主導治験2件、又は医師主
導治験1件、かつ臨床研究40件
○主導する多施設共同の特定臨床研究の実施件
数
・多施設共同医師主導治験2件、又は
・多施設共同臨床研究20件
※特定領域においても同数
○論文数
・45報以上※(英文、査読有)
※特定領域においては半数
・筆頭著者の所属機関が当該申請機関である論文
又は 研究責任者の所属機関が当該申請機関
であり、当該申請機関から研究支援を受けて研
究を実施した論文
・プロトコール論文 6報以内
○他の医療機関が行う特定臨床研究に対する支援
件数
・15件以上(支援業務数)
○特定臨床研究を行う者等への研修会の開催件数
・特定臨床研究を行う者に対する研修会6回以上
第33回 臨床研究部会
令和5年8月23日
参考資料
2-1
施設要件
人員要件
(四条の三第一項第五
号、六号、八号、九号)
(四条の三第一項第七号)
○診療科
・10以上
○病床数
・400以上
○技術能力につ
いて外部評価
を受けた臨床
検査室
○臨床研究に携わる人員数
(臨床研究支援・管理部門
等に所属する人員数)
・医師・歯科医師 5人
・薬剤師 5人
・看護師 10人
・臨床研究の実施支援者
専従24人
臨床研究コーディネーター
(CRC) / モニター/ プロジェ
クトマネージャー(スタディー
マネージャー)/ 治験・臨
床研究調整業務担当者/
研究倫理相談員/ 臨床検
査技術・品質管理者/ 研
究監査担当者/ メディカル
ライター
・データマネージャー 専従3
人
・生物統計家 専任2人
常勤換算でエフォート合計
2人
・薬事承認審査機関経験
者 専従1人
・特定臨床研究に携わる従業者に対する研修会6
回以上
・認定臨床研究審査委員会の委員に対する研修
会3回以上
1