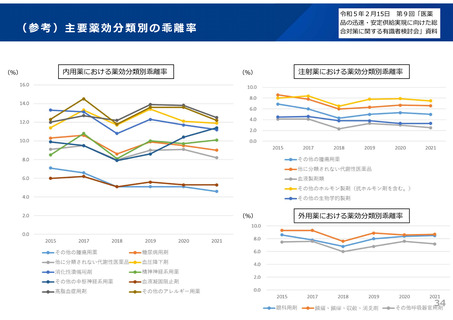
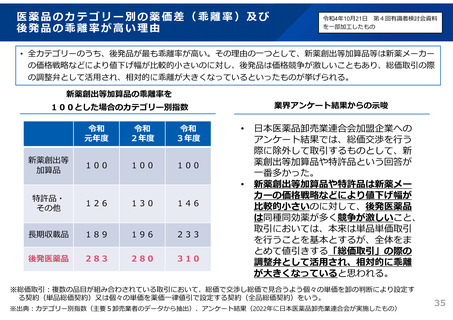
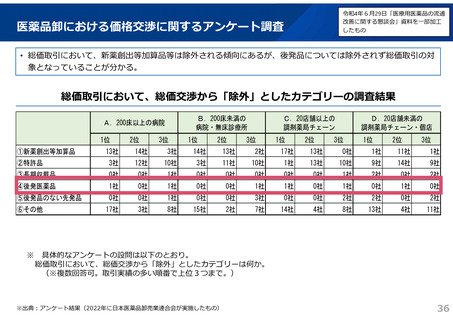
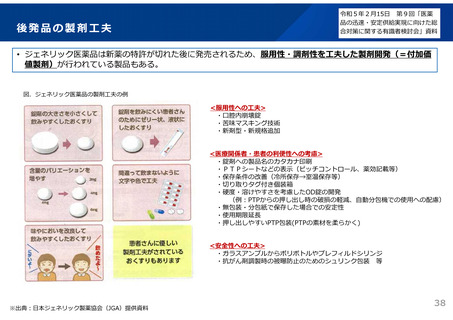
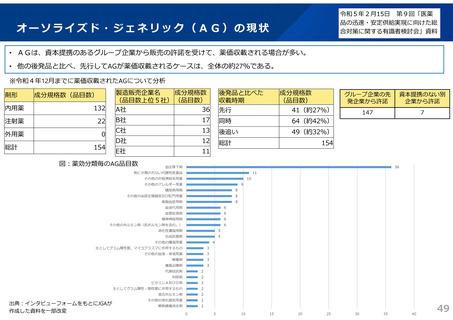
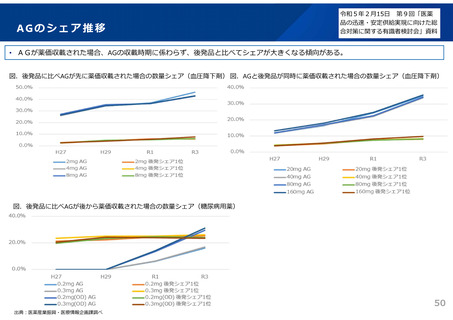
よむ、つかう、まなぶ。
資料1 後発医薬品産業の現状等について (29 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_34511.html |
| 出典情報 | 後発医薬品の安定供給等の実現に向けた 産業構造のあり方に関する検討会(第1回 7/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
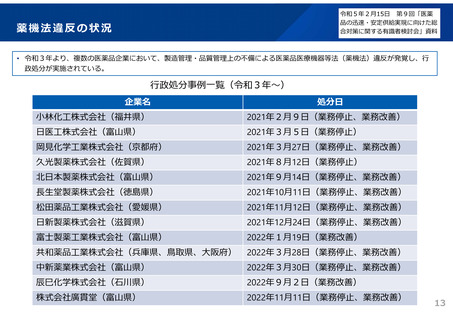
後発品の承認審査時における対応(令和3年7月)
○
○
令和5年2月15日 第9回「医薬
品の迅速・安定供給実現に向けた総
合対策に関する有識者検討会」資料
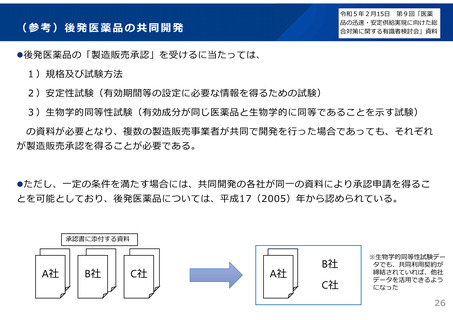
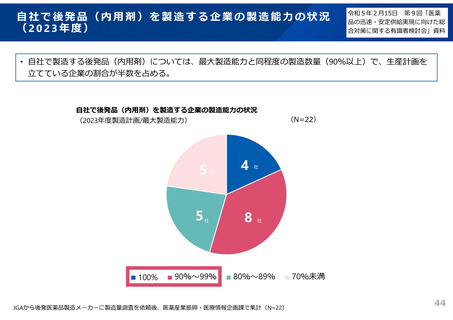
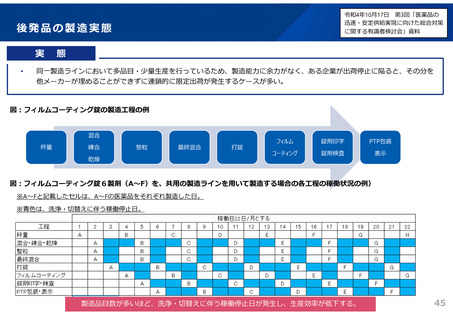
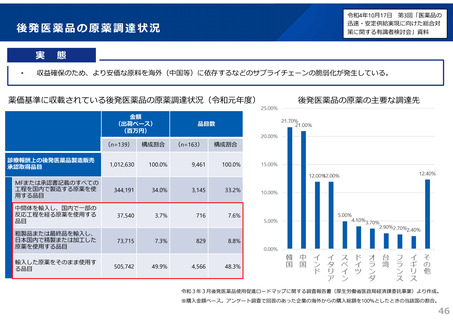
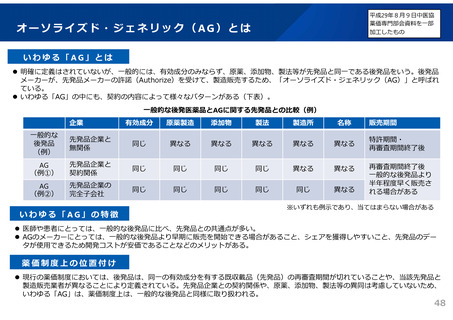
後発品の承認審査時において、以下の事項について確認することとした。
(令和3年7月2日付け通知「医療用後発医薬品の承認審査時における新たな対応について」)
また、承認申請資料の信頼性確保を目的として、調査対象品目を増やすなど、承認申
請資料適合性調査の体制を強化。
新 承認申請者の責任の確認
○ 共同開発であっても自社開発と同様に製品データ(承認申請資料)を作成・把握する責任
があることから、それが担保されているか確認する。
・ 承認申請時の添付資料として、製品データへ実際にアクセスでき、信頼性を確認できる
規定が盛り込まれている共同開発契約書、さらには、実際にどのように製品データを確認
したかを説明する資料の提出を求める。
・ 承認審査において、当該資料を厳格に確認・評価する。
新 製造・品質管理体制の確認
○
製造品目数、製造量等に見合った管理体制が確保されているか確認する。
・ 承認時のGMP調査において、当該申請品目の製造所における、製造品目数、製造量等に
見合った製造・品質管理体制が確保されていることを確認する。
→
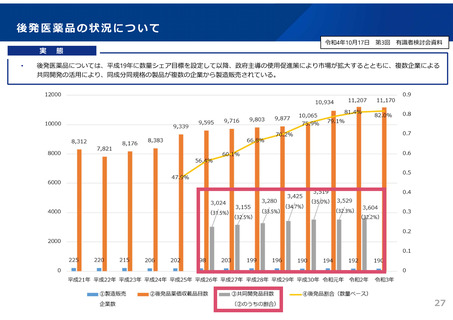
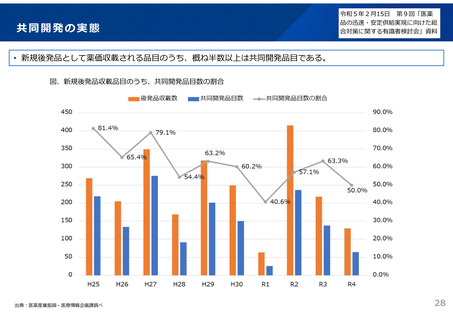
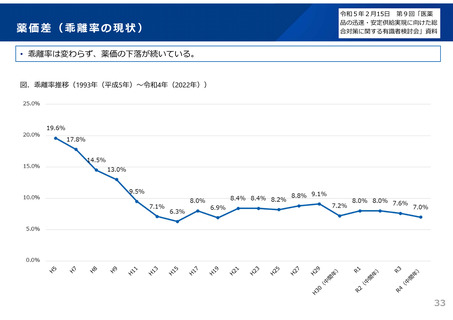
後発品の申請件数は、平成29~令和2年度は年間平均約400件であったが、通知発出後の
令和3年度は約200件に減少。引き続き、承認審査時において必要な確認を強化していく。 2929
○
○
令和5年2月15日 第9回「医薬
品の迅速・安定供給実現に向けた総
合対策に関する有識者検討会」資料
後発品の承認審査時において、以下の事項について確認することとした。
(令和3年7月2日付け通知「医療用後発医薬品の承認審査時における新たな対応について」)
また、承認申請資料の信頼性確保を目的として、調査対象品目を増やすなど、承認申
請資料適合性調査の体制を強化。
新 承認申請者の責任の確認
○ 共同開発であっても自社開発と同様に製品データ(承認申請資料)を作成・把握する責任
があることから、それが担保されているか確認する。
・ 承認申請時の添付資料として、製品データへ実際にアクセスでき、信頼性を確認できる
規定が盛り込まれている共同開発契約書、さらには、実際にどのように製品データを確認
したかを説明する資料の提出を求める。
・ 承認審査において、当該資料を厳格に確認・評価する。
新 製造・品質管理体制の確認
○
製造品目数、製造量等に見合った管理体制が確保されているか確認する。
・ 承認時のGMP調査において、当該申請品目の製造所における、製造品目数、製造量等に
見合った製造・品質管理体制が確保されていることを確認する。
→
後発品の申請件数は、平成29~令和2年度は年間平均約400件であったが、通知発出後の
令和3年度は約200件に減少。引き続き、承認審査時において必要な確認を強化していく。 2929