よむ、つかう、まなぶ。
【資料3-1】鹿野参考人提出資料:小児がん及び小児希少難治性疾患に係る医薬品開発の推進制度に資する調査研究 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
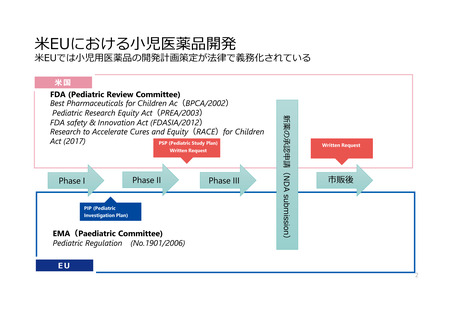
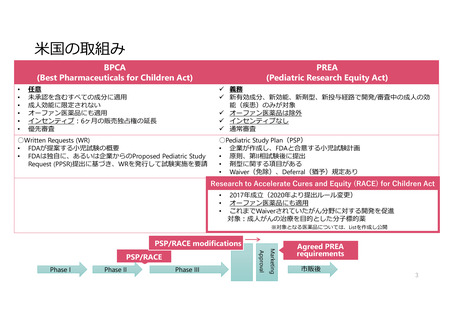
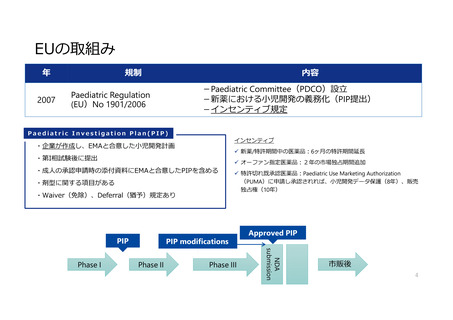
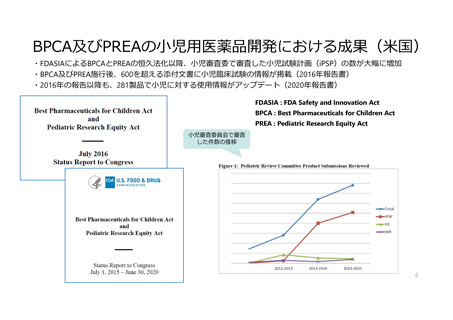
米国の取組み
BPCA
(Best Pharmaceuticals for Children Act)
•
•
•
•
•
•
PREA
(Pediatric Research Equity Act)
任意
未承認を含むすべての成分に適用
成人効能に限定されない
オーファン医薬品にも適用
インセンティブ:6ヶ月の販売独占権の延長
優先審査
義務
新有効成分、新効能、新剤型、新投与経路で開発/審査中の成人の効
能(疾患)のみが対象
オーファン医薬品は除外
インセンティブなし
通常審査
○Written Requests (WR)
• FDAが提案する小児試験の概要
• FDAは独自に、あるいは企業からのProposed Pediatric Study
Request (PPSR)提出に基づき、WRを発行して試験実施を要請
○Pediatric Study Plan(PSP)
• 企業が作成し、FDAと合意する小児試験計画
• 原則、第II相試験後に提出
• 剤型に関する項目がある
• Waiver(免除)、Deferral(猶予)規定あり
Research
Accelerate
forChildren
ChildrenAct
Act
Researchtoto
AccelerateCures
Curesand
and Equity
Equity (RACE)
(RACE) for
•
•
•
2017年成立(2020年より提出ルール変更)
オーファン医薬品にも適用
これまでWaiverされていたがん分野に対する開発を促進
対象:成人がんの治療を目的とした分子標的薬
※対象となる医薬品については、Listを作成し公開
PSP/RACE modifications
Phase II
Phase III
Marketing
Phase I
Approval
PSP/RACE
Agreed PREA
requirements
市販後
3
BPCA
(Best Pharmaceuticals for Children Act)
•
•
•
•
•
•
PREA
(Pediatric Research Equity Act)
任意
未承認を含むすべての成分に適用
成人効能に限定されない
オーファン医薬品にも適用
インセンティブ:6ヶ月の販売独占権の延長
優先審査
義務
新有効成分、新効能、新剤型、新投与経路で開発/審査中の成人の効
能(疾患)のみが対象
オーファン医薬品は除外
インセンティブなし
通常審査
○Written Requests (WR)
• FDAが提案する小児試験の概要
• FDAは独自に、あるいは企業からのProposed Pediatric Study
Request (PPSR)提出に基づき、WRを発行して試験実施を要請
○Pediatric Study Plan(PSP)
• 企業が作成し、FDAと合意する小児試験計画
• 原則、第II相試験後に提出
• 剤型に関する項目がある
• Waiver(免除)、Deferral(猶予)規定あり
Research
Accelerate
forChildren
ChildrenAct
Act
Researchtoto
AccelerateCures
Curesand
and Equity
Equity (RACE)
(RACE) for
•
•
•
2017年成立(2020年より提出ルール変更)
オーファン医薬品にも適用
これまでWaiverされていたがん分野に対する開発を促進
対象:成人がんの治療を目的とした分子標的薬
※対象となる医薬品については、Listを作成し公開
PSP/RACE modifications
Phase II
Phase III
Marketing
Phase I
Approval
PSP/RACE
Agreed PREA
requirements
市販後
3