よむ、つかう、まなぶ。
【資料2】希少疾病用医薬品の指定のあり方について (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00028.html |
| 出典情報 | 創薬力の強化・安定供給の確保等のための薬事規制のあり方に関する検討会(第1回 7/10)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
希少疾病用医薬品の指定要件の見直しについて
▍ドラッグ・ロスの指摘やその原因
• 近年、海外で承認されている医薬品が日本では開発に着手すらされない、
「ドラッグ・ロス」が拡大しているとの指摘がある。
• この原因としては、日本の医薬品市場の魅力低下や創薬環境・薬事制度等が
あると考えられ、複数の要因が複合的に関わっている。
>
「輪切り」の要件の明確化
→10ページ
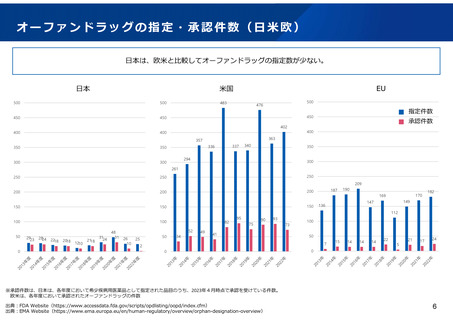
• 製薬業界からは、日本の希少疾病用医薬品の指定範囲は欧米と比べて狭く、
これが日本における開発促進を妨げる要因のひとつとなっていると指摘され
ている。
▍オーファン指定が創薬に与える影響
• 希少疾病用医薬品の指定は、開発のインセンティブとなるものであるが、上
記のような背景から、この指定を拡充することのみをもってドラッグ・ロス
の問題が全て解決できるものではない。
>
医療上の必要性の要件の明確化
→11ページ
• 他方、製薬協のアンケート結果によると、希少疾病用医薬品に指定されな
かったことにより開発計画に影響を与えた品目は、86品目中13品目あり、
実際の開発に一定の影響を与えていると考えられる。
• また、特にベンチャー企業においては、投資の呼び込みに当たって希少疾病
用医薬品の指定は大きな要素であると言われている。
• このため、日本の創薬環境を改善し、多くの革新的な医薬品がより早期に医
療現場に届けられることに資するよう、希少疾病用医薬品の指定要件につい
て、必要な見直しを3つの観点から検討したい。
• なお、これらの方針に基づく具体的な取扱いについては、今後、通知やQA
により示していくことを想定している。
>
指定の早期化と取り消し要件の明確化
→12ページ
9
▍ドラッグ・ロスの指摘やその原因
• 近年、海外で承認されている医薬品が日本では開発に着手すらされない、
「ドラッグ・ロス」が拡大しているとの指摘がある。
• この原因としては、日本の医薬品市場の魅力低下や創薬環境・薬事制度等が
あると考えられ、複数の要因が複合的に関わっている。
>
「輪切り」の要件の明確化
→10ページ
• 製薬業界からは、日本の希少疾病用医薬品の指定範囲は欧米と比べて狭く、
これが日本における開発促進を妨げる要因のひとつとなっていると指摘され
ている。
▍オーファン指定が創薬に与える影響
• 希少疾病用医薬品の指定は、開発のインセンティブとなるものであるが、上
記のような背景から、この指定を拡充することのみをもってドラッグ・ロス
の問題が全て解決できるものではない。
>
医療上の必要性の要件の明確化
→11ページ
• 他方、製薬協のアンケート結果によると、希少疾病用医薬品に指定されな
かったことにより開発計画に影響を与えた品目は、86品目中13品目あり、
実際の開発に一定の影響を与えていると考えられる。
• また、特にベンチャー企業においては、投資の呼び込みに当たって希少疾病
用医薬品の指定は大きな要素であると言われている。
• このため、日本の創薬環境を改善し、多くの革新的な医薬品がより早期に医
療現場に届けられることに資するよう、希少疾病用医薬品の指定要件につい
て、必要な見直しを3つの観点から検討したい。
• なお、これらの方針に基づく具体的な取扱いについては、今後、通知やQA
により示していくことを想定している。
>
指定の早期化と取り消し要件の明確化
→12ページ
9